
科目: 来源: 题型:
【题目】甲酸钙用途广泛,可用于高硫烟气脱硫助剂,也可作为制备草酸的中间体.据最新文献,氢氧化钙碳基化合成甲酸钙的反应如下:
![]() 反应1
反应1
(1)反应体系中存在以下两个竞争反应
![]() 反应2
反应2
![]() 反应3
反应3
![]() 二氧化碳与氢气直接合成甲酸的热化学反应方程式为 ______ .
二氧化碳与氢气直接合成甲酸的热化学反应方程式为 ______ .
![]() 为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和 ______
为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和 ______ ![]() 填编号
填编号![]() .
.
A.催化剂![]() 低压
低压![]() 高压
高压
(2)如图1是反应2和反应3,lnK与温度T的关系;同一条件时反应2的K ______ ![]() 填“大于”或“小于”
填“大于”或“小于”![]() 反应3的K,这对于 ______
反应3的K,这对于 ______ ![]() 填“反应2”或“反应3”
填“反应2”或“反应3”![]() 不利的.
不利的.
(3)以氢氧化钙初始密度为![]() 、CO的分压为
、CO的分压为![]() 条件下催化反应,以氢氧化钙转化率
条件下催化反应,以氢氧化钙转化率![]() 为坐标,时间为横坐标得到如图2;
为坐标,时间为横坐标得到如图2;

![]() 根据图象选择合适的反应温度 ______ ;理由是 ______ .
根据图象选择合适的反应温度 ______ ;理由是 ______ .
![]() 当
当![]() 为
为![]() 时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有 ______
时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有 ______ ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A.酸性强弱:HX>HY>HZ
B.P点对应的溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
C.各溶液在滴定过程中任何时刻,溶液中水的电离一直受抑制
D.HZ的电离方程式为:HZ![]() H++Z-
H++Z-
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
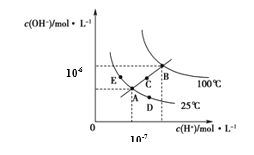
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目: 来源: 题型:
【题目】水煤气变换反应是重要的化工过程,反应方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH。我国科学家在这一变换中利用双功能催化剂突破了低温下高转化率与高反应速率不能兼得的难题。反应历程如图所示:

下列说法错误的是( )
A.该反应ΔH<0
B.根据历程图示过程Ⅰ为吸热过程、过程Ⅲ为放热过程
C.整个历程中两个H2O分子都参与了反应
D.使用双功能催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目: 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
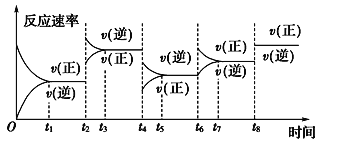
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=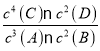
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡正向移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com