
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)被氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。回答下列问题:

(1)图中A、C分别表示:________、________。
(2)图中ΔH=___kJ·mol-1。
(3)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH 并写出其热化学反应方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
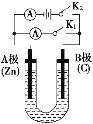
(1)断开K2,闭合K1,若所盛溶液为CuSO4溶液,则A极为________极,B极的电极反应式为_________________________________________。若所盛溶液为KCl溶液,则B极的电极反应式为__________________________________。
(2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可以观察到的现象是________,Na+移向________(填“A”或“B”)极。
②B电极上的电极反应式为______________________________________,总反应的化学方程式是_________________________________________。
③反应一段时间后断开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为________。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”、“碱”或“中”),其原因是________(用离子方程式表示)。
(2)比较②③溶液中,c(NH4+)的大小关系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 离子的浓度为0.1mol/L;NH3H2O和_____离子的物质的量浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】氟及其化合物在生产生活中被广泛使用,造福人类。
(1)氟在元素周期表中的位置是___________。
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式____________。已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度由大到小的顺序为_____。
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为_______。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是________NA。N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,写出该反应的离子方程式______________。
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是 _____________。
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。

已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=﹣lgY.下列叙述不正确的是( )
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p![]() 的变化关系
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用手持技术探究氢氧化铝制备实验电导率(电导率越大表示导电能力越强)的变化,浓度均为0.5 mol·L-1 的氢氧化钠和氨水分别滴定0.01 mol·L-1硫酸铝溶液,电导率变化曲线如图所示,下列说法错误的是
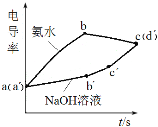
A.a(a)点溶液pH<7
B.bc段电导率下降是因为生成了Al(OH)3沉淀
C.ab段和bc段使用碱的体积比约为3:1
D.b点溶液:c(H+)<2c(SO42-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________;
(2)图中△H=__KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组将废铁屑(含硫化亚铁等杂质)和稀硫酸加入锥形瓶中,加热,充分反应,冷却后加入氨水,制得硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O],装置如下图(夹持仪器略去)。下列说法或操作错误的是
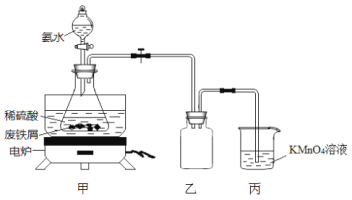
A.乙装置是安全瓶
B.将氨水滴入时,先缓慢打开活塞,再打开玻璃塞
C.KMnO4溶液的作用是吸收H2S等尾气,防止污染空气
D.锥形瓶中发生中和反应的离子方程式:NH3·H2O+H+=NH4++H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】近日,科学家发表了高温二氧化碳电解发展报告,利用固体氧化物电解池将CO2和H2O转化为合成气并联产高纯度O2。原理如图所示。下列说法正确的是
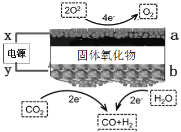
A.x极为电源正极
B.当有2 mol电子流向a极时,产生0.5 molO2
C.b极CO2的反应式:CO2+2H++2e-=CO+H2O
D.电解质中阴离子由a向b移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com