
科目: 来源: 题型:
【题目】下图为相关物质间的转化关系,其中甲、丙为生活中常见的金属单质,乙、丁为非金属单质且丁为气态,E为白色沉淀,D为浅绿色溶液。请回答:

(1)组成甲的元素在元素周期表中的位置为____________,请列举乙单质的一种用途__________,用电子式表示丁的形成过程________________________
(2)在C溶液中滴入2滴酚酞,再逐滴加入稀盐酸至红色消失,可得到一种胶体,该胶体的胶粒成分是________________(化学式)
(3)反应①的离子方程式为____________________________
(4)将B的稀溶液加水稀释,在图中画出溶液的pH随加水体积的变化趋势曲线。__________

(5)将等物质的量的A和NaOH混合溶于水,该溶液中离子的物质的量浓度由大到小的顺序为:________________________
(6)若反应②中盐酸过量,向D溶液中滴加84消毒液,溶液的颜色发生了变化,该反应的离子方程式为________________________________________,小辉同学欲设计实验,验证D溶液中的阳离子尚未完全被氧化,请你将实验过程补充完整:取反应液少许于试管中,滴加______________________,则证明D中的阳离子未完全被氧化。
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
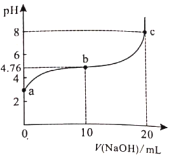
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )。
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH一定等于7
B.0.1molAgCl和0.1AgBr混合后加入水中,所得溶液![]()
C.向0.1mol/LNa2SO3溶液中通SO2气体至溶液pH=7:![]()
D.0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合pH>7:c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1) A元素基态原子占据最高能级的电子云轮廓图为_________;B元素原子中未成对电子为_________,E元素原子核外由_________种运动状态不同的电子。
(2)写出C元素基态原子的电子排布式:_____________________。
(3)D元素的价层电子排布图为:_________________________。
(4)元素B与D的电负性的大小关系是B____________(填“>”“<”或“=”,下同)D,E与C的第一电离能大小关系是E________C。
(5)写出元素C的单质和元素E的最高价氧化物的水化物的水溶液反应的离子方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如下:
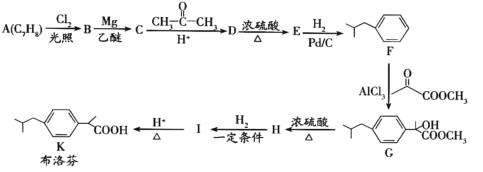
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]()
②![]()
![]()
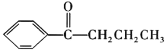 +HCl
+HCl
回答下列问题:
(1)A 的化学名称_____,G→H 的反应类型_____,H 中官能团的名称_________。
(2)分子中所有碳原子可能在同一平面上的 E 的结构简式_____。
(3)I→K 的化学方程式为_____。
(4)写出符合下列条件的 D 的同分异构体的结构简式_____ (不考虑立体异构)。
①能与 FeCl3溶液发生显色反应;
②分子中有一个手性碳原子;
③核磁共振氢谱有七组峰
(5)写出以间二甲苯、CH3COCl 和(CH3)2CHMgCl 为原料制备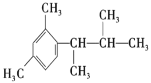 的合成路线________ (无机试剂任选)
的合成路线________ (无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】中华优秀传统文化涉及到很多的化学知识,下列有关说法错误的是
A.“日照澄洲江雾开”中伴有丁达尔效应
B.古剑“沈卢”以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
C.“粉身碎骨浑不怕,要留清白在人间”指的是物质发生了物理变化
D.“煤饼烧蛎房成灰![]() 蛎房即牡蛎壳
蛎房即牡蛎壳![]() ”中灰的主要成分为碳酸钙
”中灰的主要成分为碳酸钙
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率________(填“增大”“减小”或“不变”)。
(2)已知几种化学键的键能数据如表(亚硝酰氯的结构式为Cl—N=O):
化学键 | NO | Cl—Cl | Cl—N | N=O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
(3)在1 L的恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图:
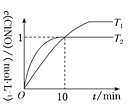
①从反应开始到10 min时NO的平均反应速率v(NO)=________mol·L-1·min-1。
②T2时该反应的平衡常数K=________。
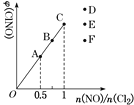
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数可能是D、E、F三点中的________点。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:

则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:

①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______

A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。

①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1;
O2(g)=CO2(g)△H=-283.0kJmol-1;
H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;
O2(g)=H2O(l)△H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g)△H=___________kJmol-1.
CH3OH(g)△H=___________kJmol-1.
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___________(填写序号).
a.使用催化剂;b.降低反应温度;
c.增大体系压强;d.不断将CH3OH从反应混合物中分离出来;
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示.
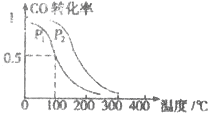
①P1___________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=___________;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,则平衡___________(填“向左”“不”或“想右”)移动
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___________;
(5)CaSO3溶液与CaC12溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。用CaSO3溶液充分吸收SO2得NaHSO2溶液,然后电解该溶液,电解原理示意图如下图所示。请写出该电解池发生反应的化学方程式___________。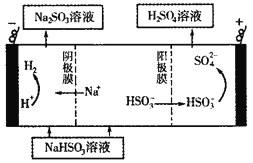
查看答案和解析>>
科目: 来源: 题型:
【题目】辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程度上预防心脏病,也能缓解肌肉关节疼痛。辣椒素酯类化合物的结构可以表示为:
 (R为烃基)
(R为烃基)
其中一种辣椒素酯类化合物J的合成路线如下:
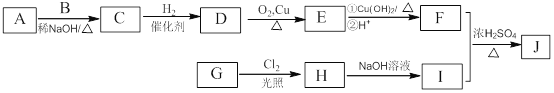
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G所含官能团的名称为 。
(2)由A和B生成C的化学方程式为 。
(3)由C生成D的反应类型为 ,D的化学名称为 。
(4)由H生成I的化学方程式为 。
(5)J的结构简式为 。
(6)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com