
科目: 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试
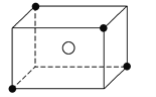
(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
实验编号 | H2C2O4溶液 | 酸性KMnO4 | 温度 | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
0.10 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 50 | |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥__。
(2)试验编号②和③探究的内容是____。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=___mol·L-1·min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图示填空。
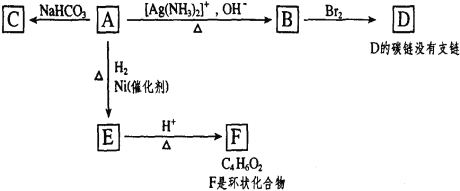
(1)化合物A含有的官能团是___。
(2)由A生成B的反应类型是___,由E生成F的反应类型是___。
(3)与A具有相同官能团的A的同分异构体的结构简式是___。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是___。
(5)F的结构简式是_______。
(6)1 mol A与2 mol H2反应生成1 mol E,其反应方程式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是
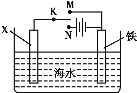
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2。某校化学研究小组利用下图实验装置检验产物中的H2和CO(设气体均被充分吸收)。下列有关说法正确的是

A. ②、③、⑤中依次盛装澄清石灰水、浓硫酸和氢氧化钠溶液
B. 为了实验安全性,应先点燃①处酒精灯,后点燃④处酒精灯
C. 当黑色氧化铜变红色,即可证明产物中一定含有H2 和CO
D. 若用碱石灰替换无水硫酸铜,也可达到检验H2 和CO目的
查看答案和解析>>
科目: 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法不正确的是( )
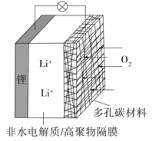
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向锂电极迁移
D.充电时,电池总反应为Li2O2-x=2Li+ (1-![]() )O2
)O2
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下pH为2的盐酸,下列叙述正确的是( )
A.将10mL该溶液稀释至100mL后,pH=4
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1
D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com