
科目: 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A. 水分子的比例模型![]()
B. 过氧化氢的电子式为:![]()
C. 石油的分馏和煤的气化、液化均为物理变化
D. 甲基环丁烷二氯代物的同分异构体的数目是10种(不考虑立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上“固定”和利用CO2能有效地减轻“温室效应”。
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJmol﹣1,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
CH3OH(g)+H2O(g) △H=-49.0kJmol﹣1,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
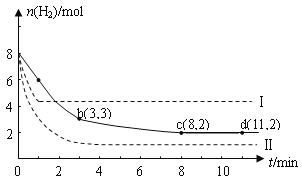
回答下列问题:
(1)以下说法不正确的是(__________)
A.0~1min的平均反应速率大于3~4min的平均反应速率
B.达到平衡时H2的转化率为75%
C. 在其它条件不变时,若提高反应的温度正反应速率增大,逆反应速率减小
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常数为K,虚线I对应条件下平衡常数为K1,虚线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是____。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:
物质的化学式 | CH3COOH | H2CO3 | |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则(NH4)2CO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0.lmolL﹣1乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中![]() =_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,人类可以从海水中提取各种化工产品。下图是某工厂对海水综合利用的示意图:
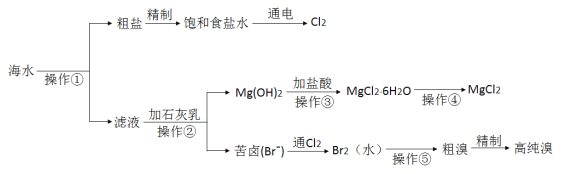
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________,检验氯气生成的方法是_________。
(2)液氯储存在钢瓶中,钢瓶上应贴的标签为_________________(选填编号)。
a.自燃品 b.爆炸品 c.有毒品 d.易燃品
(3)Mg(OH)2加入盐酸充分反应后,操作③ 是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为____________________________。
(4)操作④是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因________________。
(5)操作⑤是向溶液中鼓入__________,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有____________性。
(6)粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br,再通Cl2,最后蒸馏得到高纯溴。用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为_________。由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,工业上常用NaClO氧化Fe(OH)3生产高铁酸钠:
完成下列填空:
(1)配平上述化学方程式:___ Fe(OH)3 + ___ NaClO + ___ NaOH → ____ Na2FeO4 +___ NaCl +___ H2O
(2)其中发生还原反应的元素是__________;若制备过程中消耗了0.15 mol NaClO,则转移的电子数目是____________________。
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)_________________________________________________。
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe + 2NaOH + 2 H2O → Na2FeO4 + 3 H2↑
则电解过程中Fe在_________。(选填编号)
a. 阳极发生氧化反应 b. 阴极发生还原反应
c. 阳极发生还原反应 d. 阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a_______0.16 (填“>”、“<”或“=”),判断的理由是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中产物一定不存在同分异构体的反应是 ( )
A.异戊二烯[CH2=C(CH3)CH=CH2]与等物质的量的Br2发生加成反应
B.1—丁烯(CH3CH2CH=CH2)与HCl分子发生的加成反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.苯甲酸(![]() )与NaHCO3溶液反应
)与NaHCO3溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某高分子材料的结构如图所示: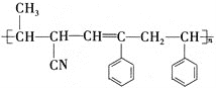 ,已知该高分子材料是由三种单体聚合而成的,以下与此高分子材料相关的说法正确的是
,已知该高分子材料是由三种单体聚合而成的,以下与此高分子材料相关的说法正确的是
A.合成该高分子的反应是缩聚反应
B.形成该高分子材料的单体![]() 中,所有原子可能处于同一平面内
中,所有原子可能处于同一平面内
C.三种单体中有两种有机物互为同系物
D.三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是重要的半导体材料,是构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在工业上,高纯硅可以通过下列流程制取:
![]()
完成下列填空:
(1)氯原子核外有_______种不同能量的电子,硅原子的核外电子排布式是_______________。
(2)碳与硅属于同主族元素,熔沸点SiO2 ________CO2 (填写“>”、“<”或“=”),其原因是_____________________________________________________。
(3)流程中由SiO2制粗硅的反应不能说明碳的非金属性强于硅,原因是_________________;请写出一个能说明碳的非金属性强于硅的化学方程式______________________________。
(4)SiHCl3(g) + H2(g)![]() Si(s) + 3HCl(g) -Q (Q>0)
Si(s) + 3HCl(g) -Q (Q>0)
①上述反应的平衡常数表达式K=_____________;能使K增大的措施是_______________。
②一定条件下,在固定容积的密闭容器中,能表示上述反应达到平衡状态的是________(选填编号)。
a.3v逆(SiHCl3)=v正(HCl) b.混合气体的压强不变
c.K保持不变 d.c(SiHCl3)∶c(H2)∶c(HCl)=1∶1∶3
③一定温度下,在2L密闭容器中进行上述反应,5min后达到平衡,此过程中固体质量增加0.28g,此时HCl的化学反应速率为 ________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸钠(NaH2PO2)常用作化学镀剂、食品及工业锅炉水添加剂、抗氧剂。实验室可用如图所示装置制取一定量的次磷酸钠。已知PH3是一种无色、有毒且能自燃的气体。

回答下列问题:
(1)装烧碱溶液的仪器名称是___,已知NaH2PO2与盐酸反应但不能与NaOH溶液反应,则次磷酸(H3PO2)是___元弱酸。
(2)实验开始时,首先要打开K1,通入一段时间N2,其目的是___,为尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是___,a中反应的化学方程式为___。
(3)装置C中物质反应后生成了NaCl、NaH2PO2,通过___的方法可分离出NaH2PO2固体(已知NaH2PO2在25℃时溶解度为100g,100℃时溶解度为667g)。
(4)产品纯度测定:取产品mg,将其溶于水配成250mL溶液,再用___(填“酸式”或“碱式”)滴定管取25.00mL溶液于锥形瓶中,然后用0.01mol·L-1的KMnO4标准溶液滴定(氧化产物是PO43-),达到滴定终点时消耗V1mLKMnO4标准溶液,滴定终点的现象是___,产品纯度为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】固体离子导体依靠离子迁移传导电流。如图是一种固体电池,Ag+可以在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池。下列说法错误的是( )
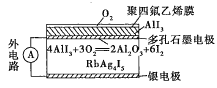
A.I2与Ag反应属于放热反应
B.Ag+从多孔石墨电极向银电极移动
C.多孔石墨电极为正极,银电极为负极
D.银电极的电极反应式为Ag-e-=Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )
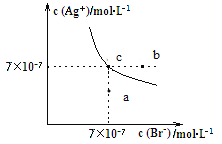
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com