
科目: 来源: 题型:
【题目】某恒温下,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
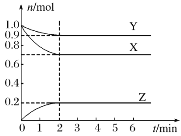
(1)反应开始至2min,以气体Z表示的平均反应速率为___;
(2)达平衡时X与Y的转化率之比为__;
(3)反应达到平衡时:压强是开始时的__倍;
(4)若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__(填“放热”或“吸热”)反应。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__(填“放热”或“吸热”)反应。
(5)达平衡时该反应放出9.2kJ的热量,则该反应的热化学方程式为:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有容积为1 L的甲乙两个恒温恒容密闭容器,向甲中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g)![]() C(g) △H= -a kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是( )
C(g) △H= -a kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是( )
A.Q1 + Q2= aB.Q1 + 2Q2< 2aC.Q1 + 2Q2> 2aD.Q1 + Q2< a
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式,回答下列问题:
①2H2(g)+O2(g)=2H2O(l) ΔH=﹣570kJ![]()
②2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ![]()
③2C(s)+O2(g)=2CO(g) ΔH=﹣220.8kJ![]()
④C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ![]()
(1)上述反应中属于放热反应的是_____(填写序号);
(2)H2的燃烧热为_____;
(3)燃烧8g H2生成液态水,放出的热量为_____;
(4)H2O(l)=H2O(g)ΔH=______;
(5)CO的燃烧热的热化学方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
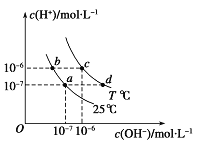
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
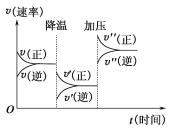
A.温度越高,该反应的化学平衡常数越大B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应D.A、B、C、D均为气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语表达正确的是
A. NaHS的电离:NaHS = Na+ + H+ + S2-
B. 把金属铁放入稀硝酸中: Fe + 2H+ = Fe2+ + H2↑
C. NaHCO3溶液与少量的澄清石灰水反应:HCO3- + OH- + Ca2+ = CaCO3↓+ H2O
D. HClO的电离:HClO ![]() H+ + ClO-
H+ + ClO-
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
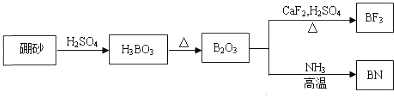
请回答下列问题:
⑴由B2O3制备BN的化学方程式是_______。
⑵基态B原子的电子排布式为_____;B和N相比,电负性较大的是_____,BN中B元素的化合价为_____。
⑶在BF3分子中,F-B-F的键角是_____,B原子的杂化轨道类型为_____,BF3和过量NaF作用可生成NaBF4,![]() 的立体构型为_____。
的立体构型为_____。
⑷氮化硼晶体有多种结构,如立方氮化硼和六方氮化硼等。立方氮化硼结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,则立方氮化硼的密度是______________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA mol-1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】KClO3热分解是实验室制取氧气的一种方法,1molKClO3(s)热分解的能量变化如图所示。实验测得第一放热温度为400℃,第二放热温度为480℃。下列说法正确的是( )
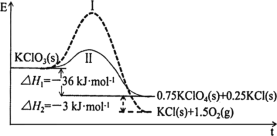
A.400℃时KClO3热分解的产物是KCl和O2
B.若用MnO2作催化剂,KClO3热分解温度大于480℃
C.曲线Ⅰ的活化能大于曲线Ⅱ,所以KClO3比KClO4稳定
D.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol1
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )

A.该反应的焓变和熵变:ΔH>0,ΔS<0
B.温度降低,该反应的平衡常数K增大
C.升高温度,n(CH3OH)/n(CO2)增大
D.从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com