
科目: 来源: 题型:
【题目】已知反应aA(g)+bB(g)![]() cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
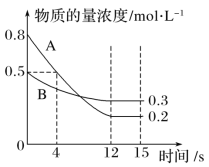
(1)从反应开始到12s时,用A表示的反应速率为___。
(2)经测定,前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为___。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测量三个容器中的反应速率分别为甲:v(A)=0.3mol·L-1·s-1,乙:v(B)=0.12mol·L-1·s-1,丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】硒鼓回收料含硒约![]() ,其余为约
,其余为约![]() 的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示
的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示![]() 已知煅烧过程中,回收料中的硒、碲被氧化成
已知煅烧过程中,回收料中的硒、碲被氧化成![]() 和
和![]() :
:
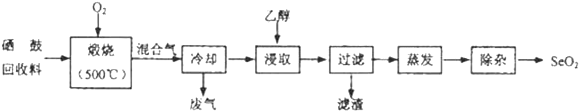
部分物质的物理性质如表:
物质 | 熔点 | 沸点 | 溶解度 |
|
|
| 易溶于水和乙醇 |
|
|
| 微溶于水,不溶于乙醇 |
回答下列问题:
(1)![]() 与S是同族元素,比S多1个电子层,Se在元素周期表的位置为______;
与S是同族元素,比S多1个电子层,Se在元素周期表的位置为______;![]() 的热稳定性比
的热稳定性比![]() 的热稳定性______
的热稳定性______![]() 填“强”或“弱”
填“强”或“弱”![]() .
.
(2)乙醇浸取后过滤所得滤渣的主要成分是______![]() 蒸发除去溶剂后,所得固体中仍含有少量
蒸发除去溶剂后,所得固体中仍含有少量![]() 杂质,除杂时适宜采用的方法是______.
杂质,除杂时适宜采用的方法是______.
(3)![]() 易溶于水得到
易溶于水得到![]() 溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式______.
溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式______.
(4)已知![]() 的电离常数
的电离常数![]() 、
、![]() ,回答下列问题:
,回答下列问题:
![]() 溶液呈______性,原因是
溶液呈______性,原因是![]() 用离子方程式表示
用离子方程式表示![]() ______;
______;
![]() 在
在![]() 溶液中,下列关系式正确的是______:
溶液中,下列关系式正确的是______:
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
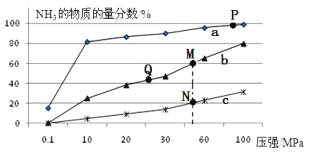
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】NaHSO4与NaHCO3是两种重要的酸式盐。
(1)NaHSO4固体溶于水显酸性,而NaHCO3固体溶于水显碱性,请用离子方程式并配以必要的文字来说明NaHCO3固体溶于水显碱性的原因___。
(2)常温下把1mL0.2mol·L-1的NaHSO4溶液加水稀释成2L溶液,此时溶液中由水电离产生的c(H+)为___。
(3)NaHSO4和NaHCO3两溶液混合反应的离子方程式为___。
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出反应的离子方程式:___;在以上溶液中,继续滴加Ba(OH)2溶液,此时反应的离子方程式为___。
(5)若将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】中科院科学家设计出-套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
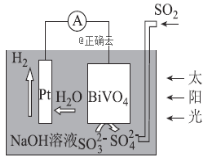
A.该电化学装置中,Pt电极作正极
B.BiVO4电极上的反应式为![]()
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.OH-移向BiVO4电极
查看答案和解析>>
科目: 来源: 题型:
【题目】A的产量可以用于衡量一个国家的石油化工发展水平。B和D是生活中两种常见的有机物,D是食醋的主要成分。相互转化关系如图所示。
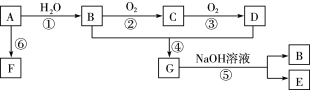
(1)A的结构简式是______,D中官能团名称是:______。
(2)在制备G的实验中,反应条件是_____,为了除去产物中的杂质所用的试剂是_____。
(3)用于鉴别A和甲烷的一种试剂是________。
(4)写出下列反应的化学方程式:①:__________,④:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料.
(1)下表是当反应器中按![]() :
:![]() :3投料后,在
:3投料后,在![]() 、
、![]() 、
、![]() 下,反应达到平衡时,混合物中
下,反应达到平衡时,混合物中![]() 的物质的量分数随压强的变化曲线.
的物质的量分数随压强的变化曲线.
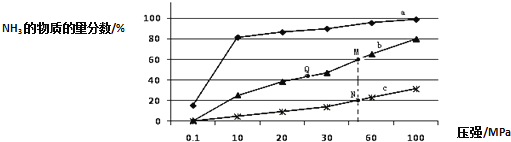
![]() 曲线a对应的温度是 ______ .
曲线a对应的温度是 ______ .
![]() 关于工业合成氨的反应,下列叙述正确的是 ______
关于工业合成氨的反应,下列叙述正确的是 ______ ![]() 填字母
填字母![]() .
.
A.及时分离出![]() 可以提高
可以提高![]() 的平衡转化率
的平衡转化率
B.加催化剂能加快反应速率且提高![]() 的平衡转化率
的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是![]()
![]() 点对应的
点对应的![]() 转化率是 ______ .
转化率是 ______ .
(2)工业制硫酸的尾气中含较多的![]() ,为防止污染空气,回收利用
,为防止污染空气,回收利用![]() ,工业上常用氨水吸收法处理尾气.
,工业上常用氨水吸收法处理尾气.
![]() 当氨水中所含氨的物质的量为3mol,吸收标准状况下
当氨水中所含氨的物质的量为3mol,吸收标准状况下![]()
![]() 时,溶液中的溶质为 ______ .
时,溶液中的溶质为 ______ .
![]() 溶液显酸性.用氨水吸收
溶液显酸性.用氨水吸收![]() ,吸收液显中性时,溶液中离子浓度关系正确的是 ______
,吸收液显中性时,溶液中离子浓度关系正确的是 ______ ![]() 填字母
填字母![]() .
.
![]()
![]()
![]()
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
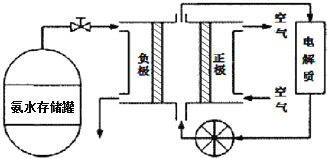
![]() 氨气燃料电池的电解质溶液最好选择 ______
氨气燃料电池的电解质溶液最好选择 ______ ![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() 溶液.
溶液.
![]() 空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
![]() 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示

步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度下,浓度都是lmol/L的两种单质气体X2和Y2,在密闭容器中反应生成气体Z。达到平衡时,X2、Y2、Z的浓度分别为0.4mol/L、0.8mol/L、0.4mol/L则该反应的化学方程式是____________________________。
(2)298K时,合成氨反应的热化学方程式为N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol,在该温度下,取lmolN2和3molH2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总是小于92.4kJ,其原因是________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com