
科目: 来源: 题型:
【题目】化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺。化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护。在ABS工程塑料表面进行化学镀镍的流程如下:
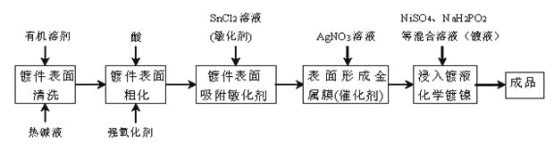
回答下列问题:
(1)化学镀与电镀比较,优点之一是_________。
(2)镀件表面用热碱液清洗的作用是_________,镀件表面粗化的目的是增强亲水性及_________。
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是_________。
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是_________。
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如下表所示:

由此推断,镀层厚度y与反应时间t的关系式为_________;欲使镀层厚度为6anm,需要的反应时间为_________。
(6)化学镀镍废液中含有Ni2+等污染物,需转化为沉淀除去。已知25℃,Ksp[Ni(OH)2]=2.0×10-15。若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为_________mg·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.0.1 mol·L-1 FeSO4溶液:Na+、K+、Cl-、![]()
B.滴入酚酞变红色的溶液:K+、Ca2+、![]() 、
、![]()
C.加入铁粉放出氢气的溶液:![]() 、Fe3+、ClO-、
、Fe3+、ClO-、![]()
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、Cl-
、S2-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为![]() ,他们设计如下实验用于制取氯气并验证其性质。
,他们设计如下实验用于制取氯气并验证其性质。
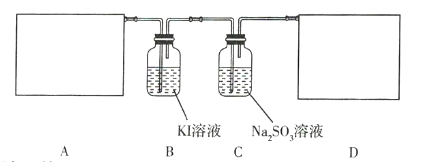
请回答下列问题。
(1)该实验中A部分的装置是 _________________________________ (填序号)。
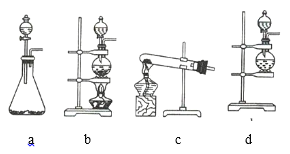
(2)B中的实验现象为 _____________________________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因: _____________________________。请你帮助他们设计一个实验,证明C中的亚硫酸钠已被氧化: _____________________________(简述实验步骤)。
(4)请根据题意画出D处的实验装置图,并注明装置中盛放的物质__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐![]() 仅含四种元素
仅含四种元素![]() 的组成和性质,设计并完成了如下实验:
的组成和性质,设计并完成了如下实验: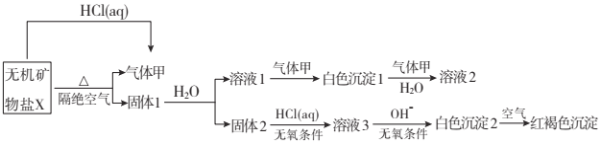
另取![]() 在惰性气流中加热至完全分解,得到
在惰性气流中加热至完全分解,得到![]() 固体1。请回答如下问题:
固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图__________,写出气体甲的电子式 __________。
(2)![]() 的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________![]() 用化学反应方程式表示
用化学反应方程式表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X由三种元素组成,为探究其组成的性质,设计并完成如下实验:
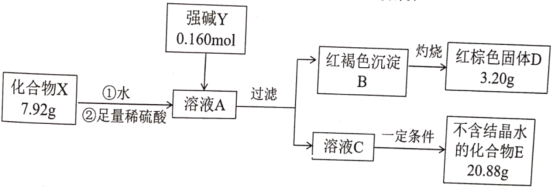
提示:化合物E的焰色反应为紫色(透过蓝色钴玻璃)
请回答:
(1)X的化学式是________________。强碱Y的电子式为________________。
(2)在常温和干燥的条件下,化合物X可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀和一种气体单质。
①化合物X与水反应的离子方程式为________________。
②人们针对化合物X的稳定性进行了大量的研究,并取得了一定的进展。下列物质可以提高化合物X在水溶液中稳定性的是________________。
A KHSO4 B K2CO3 C CH3COOK D K2SO3
③为研究温度对化合物X水溶液稳定性的影响,请设计一个实验方案:________________________________________________。
(3)化合物X有多种制备方法其中一种方法是在强碱Y条件下用次氯酸钾与红褐色沉淀B反应,其化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】TiO2和TiCl4均为重要的工业原料。已知:
Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH2= -220.9kJ·mol-1
2CO(g) ΔH2= -220.9kJ·mol-1
请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成TiO2(s)、C(s)和氯气的热化学方程式为_____________________。升高温度,对该反应的影响为___________________________________。
(2)若反应Ⅱ的逆反应活化能表示为EkJ·mol-1,则E________220.9(填“>”“<”或“=”)。
(3)t℃时,向10 L恒容密闭容器中充入1molTiCl4和2 molO2,发生反应Ⅰ。5min达到平衡时测得TiO2的物质的量为0.2 mol。
①0~5 min 内,用Cl2表示的反应速率v(Cl2)=__________。
②TiCl4的平衡转化率a=__________________。
③下列措施,既能加快逆反应速率又能增大TiCl4的平衡转化率的是__________(填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大O2浓度
④t℃时,向10 L恒容密闭容器中充入3 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(a)与起始的物质的量之比(![]() )的关系如图所示:
)的关系如图所示:
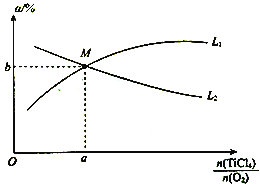
能表示TiCl4平衡转化率的曲线为__________(填“L1”或“L2”);M点的坐标为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中的甲、乙、丙、丁代表化学中常见的四种物质,其中甲、乙、丙均含有同一种元素。相互转化的关系如下,请回答下列问题。
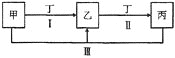
(1)甲气体的水溶液能使酚酞变红,乙为空气中含量最大的气体,写出反应![]() Ⅲ
Ⅲ![]() 的化学方程式:________________________________。
的化学方程式:________________________________。
(2)常温下![]() 的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应
的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应![]() Ⅲ
Ⅲ![]() 的离子方程式为___________________________________。
的离子方程式为___________________________________。
(3)若乙为淡黄色非金属单质,则反应![]() Ⅲ
Ⅲ![]() 中氧化产物与还原产物的物质的量之比为______________,
中氧化产物与还原产物的物质的量之比为______________,![]() 甲与含
甲与含![]() 的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
(4)若甲、乙、丙的溶液均显碱性,丁为温室效应主要气体。浓度相同的乙、丙溶液pH较大的是______________![]() 填溶质的化学式
填溶质的化学式![]() 溶液,原因是______________________________。
溶液,原因是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中常用二氧化锰和浓盐酸反应来制备氯气,实验装置如图所示。
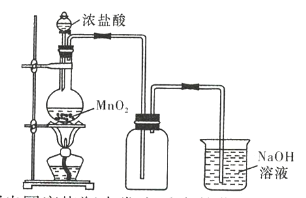
(1)写出圆底烧瓶中发生反应的化学方程式:___________________。
(2)若将过量的二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,请写出两个可能的原因:①______________________________;②______________________________。
(3)为了提高浓盐酸的利用率,请写出两条改进措施:①______________________________;②______________________________。
(4)实验结束清洗仪器时,为了减小烧瓶中残留氯气对环境的污染,可以向烧瓶中加入 _____________ ,所发生反应的离子方程式 _________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
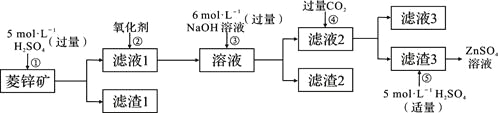
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的___(选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤_____(选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式______。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:______________________。
Ⅱ、BaS溶液的制备:
![]()
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:______。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com