
科目: 来源: 题型:
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响。结果如表所示(
废水处理的影响。结果如表所示(![]() 的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )
的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )

A.实验ⅱ与实验ⅰ对比,其他条件不变,增加c(H+)有利于![]() 的去除
的去除
B.实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于![]() 的去除
的去除
C.实验ⅲ中Fe3+循环利用提高了![]() 的去除率
的去除率
D.若实验iV中去除0.0l mol ![]() ,电路中共转移0.06 mol电子
,电路中共转移0.06 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
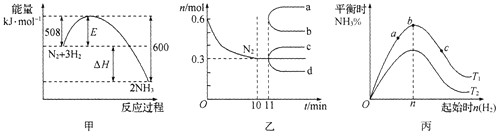
下列说法正确的是 ( )
A.升高温度,该反应的平衡常数增大
B.由图乙信息,从11 min起其他条件不变,压缩容器的体积,则n(N2)的变化曲线为d
C.由图乙信息,10 min内该反应的平均速度v(H2) = 0. 09 mol·L-l·min-l
D.图丙中温度T1 < T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
科目: 来源: 题型:
【题目】K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾晶体)为翠绿色晶体, 溶于水, 难溶于乙醇, 110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。 实验室利用(NH4)2Fe(SO4)2· 6H2O (硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
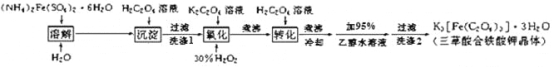
已知:沉淀FeC2O4 · 2H2O 既难溶于水又难溶于强酸
6FeC2O4 + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3↓
2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
(1)检验硫酸亚铁铵是否变质的试剂是_____;溶解时加几滴稀硫酸的目的是______。
(2)硫酸亚铁铵溶液与 H2C2O4溶液反应生成 FeC2O4 · 2H2O 沉淀,写出该反应方程式_______________;沉淀过滤后,洗涤 1 的操作方法是_______________________________。
(3)在沉淀中加入饱和 K2C2O4 溶液,并用 40 ℃ 左右水浴加热,再向其中慢慢滴加足量的 30% H2O2溶液,不断搅拌。此过程需保持温度在 40 ℃ 左右,可能的原因是_______。加入30%过氧化氢溶液完全反应后,煮沸的目的是______________。
(4)洗涤 2 中所用洗涤试剂最合适的是_______(填选项字母)。
A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl溶液
(5)为了不浪费药品,95%乙醇水溶液进行回收的方法是________,所用的主要玻璃仪器有__________(任写两种)等。
查看答案和解析>>
科目: 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)B的分子式为______________,反应①的反应类型为________________
(2)C所含官能团的名称为__________________________________________。
(3)反应⑤的化学方程式为_________________,该反应的反应类型是_________________。
(4)写出满足下列条件的E的同分异构体的结构简式:___________、______________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备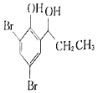 的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OHCH3COOCH2CH3)
CH3CH2OHCH3COOCH2CH3)
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液56滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解![]() 的原理如图所示。下列说法不正确的是
的原理如图所示。下列说法不正确的是
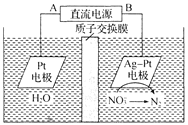
A.A为电源的正极
B.溶液中H+从阳极向阴极迁移,阴极区电解质溶液的pH保持不变
C.Ag-Pt电极的电极反应式为![]() +12H++10e-=== N2↑+6H2O
+12H++10e-=== N2↑+6H2O
D.电解过程中,每转移2 mol电子,则左侧溶液质量减少18 g
查看答案和解析>>
科目: 来源: 题型:
【题目】秋冬季我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,城市雾霾中还含有铜等重金属元素。
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() 等二次污染物。
等二次污染物。
①基态N原子的电子排布式___________;C、N和O的第一电离能由大到小的顺序为___________
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间存在的作用力有________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力
②NH4NO3中阴离子的空间构型为________,阳离子的中心原子轨道采用________杂化。

(3)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为____________,晶体中每个镁原子周围距离最近的铝原子数目为___________,该晶体的密度为__________________g/cm3(阿伏伽德罗常数的数值用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:_________________________(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________。
用作高温堆减速剂。下列说法正确的是________。
A.![]() 和
和![]() 互为同位素B.
互为同位素B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同D.
的化学性质不同D.![]() 和
和![]() 是同种物质
是同种物质
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
CO2(g) +4H2(g) ![]() CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是__________________; a=____________kJ/mol。
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
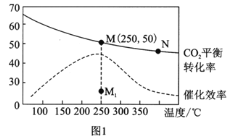
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=______MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有__________。
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是_________。
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
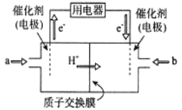
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是___________(填a或b),②负极电极反应式为___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com