
科目: 来源: 题型:
【题目】下列说法正确的是
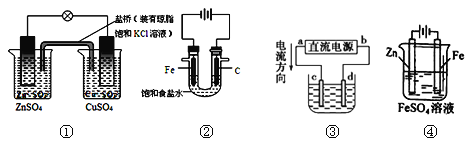
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将某一元酸![]() 甲、乙、丙、丁代表不同的一元酸
甲、乙、丙、丁代表不同的一元酸![]() 和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验 编号 | HA的物质的 量浓度 | NaOH的物质的 量浓度 | 混合后溶液的pH |
甲 |
|
| pH |
乙 |
|
| pH |
丙 |
|
|
|
丁 |
|
| pH |
![]() 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
![]() 乙组混合溶液中
乙组混合溶液中![]() 和
和![]() 的大小关系是________
的大小关系是________![]() 填标号
填标号![]() 。
。
A.前者大 ![]() 后者大
后者大
C.二者相等 ![]() 无法判断
无法判断
![]() 从丙组实验结果分析,该混合溶液中
从丙组实验结果分析,该混合溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 分析丁组实验数据,写出该混合溶液中下列算式的精确结果
分析丁组实验数据,写出该混合溶液中下列算式的精确结果![]() 列式
列式![]() :
:![]() __________
__________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂和蛋白质都是人体基本营养物质。请回答下列问题:
(1)在试管中加入![]() 淀粉和
淀粉和![]() 20%的
20%的![]() 溶液,加热3~4min,然后用碱液中和试管中的
溶液,加热3~4min,然后用碱液中和试管中的![]() 溶液。
溶液。
①淀粉完全水解生成的有机物的分子为___________________________。
②若要检验淀粉已经发生了水解,可取少量上述溶液并向其中加入___________________________(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液,向其中加入几滴碘水,可观察到___________________________。
(2)油脂在人体内通过水解生成___________________________和丙三醇,再氧化分解,为人体提供能量。
(3)为了鉴别某白色纺织品的成分是蚕丝还是“人造丝”,通常选用的方法是_____________(填序号)。
A.滴加稀盐酸 B.滴加浓硫酸 C.滴加酒精 D.在火焰上灼烧
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如下图所示,其中只有Z为金属元素。则下列说法中正确的是
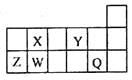
A.W、X两种元素在自然界中都存在相应的单质
B.Q、Y分别与活泼金属元素形成的化合物中仅含离子键
C.Y、Z分别形成的简单离子中,前者的半径较大
D.X、Z的最高价氧化物对应的水化物之间容易相互发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是__________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO沉淀质量,以确定碳酸钙的质量分数。
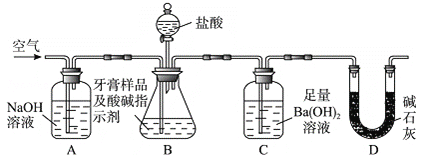
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________________。
(4)C中反应生成沉淀的离子方程式是______________________________。
(5)下列各项措施中,不能提高测定准确度的是____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体 b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取10.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而![]() 直接排放会对环境造成危害。
直接排放会对环境造成危害。
I.已知:重晶石![]() 高温缎烧可发生一系列反应,其中部分反应如下:
高温缎烧可发生一系列反应,其中部分反应如下:
![]()
![]()
![]()
![]()
已知:![]()
![]()
则:![]()
![]() _____________;
_____________;
![]() 的尾气处理通常有以下几种方法:
的尾气处理通常有以下几种方法:
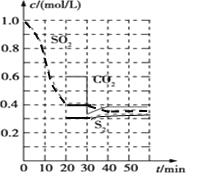
(1)活性炭还原法 反应原理:恒温恒容时![]() 反应进行到不同时间测得各物质的浓度如上图:
反应进行到不同时间测得各物质的浓度如上图:
![]() 反应速率表示为
反应速率表示为![]() _________________;
_________________;
![]() 时,改变某一条件平衡发生移动,则改变的条件最有可能是________________________;
时,改变某一条件平衡发生移动,则改变的条件最有可能是________________________;
![]() 时,平衡常数
时,平衡常数![]() _____________。
_____________。
(2)亚硫酸钠吸收法
![]() 溶液吸收
溶液吸收![]() 的离子方程式为____________
的离子方程式为____________
![]() 常温下,当吸收至
常温下,当吸收至![]() 时,吸收液中相关离子浓度关系一定正确的是_______
时,吸收液中相关离子浓度关系一定正确的是_______![]() 填序号
填序号![]()
![]()
![]()
![]()
![]() 水电离出
水电离出![]()
(3)电化学处理法
![]() 如下图所示,
如下图所示,![]() Ⅰ
Ⅰ![]() 电极的反应式为___________________;
电极的反应式为___________________;
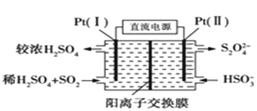
![]() 当电路中转移
当电路中转移![]() 时
时![]() 较浓
较浓![]() 尚未排出
尚未排出![]() ,交换膜左侧溶液中增加_______mol离子.
,交换膜左侧溶液中增加_______mol离子.
查看答案和解析>>
科目: 来源: 题型:
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:
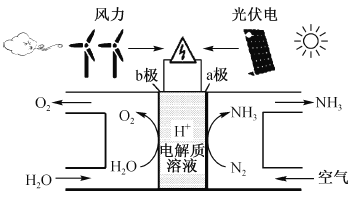
下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素可以形成多种化合物.请回答以下问题:
⑴基态氮原子的价电子排布式是____________。
⑵肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物.
①请用价电子层对互斥理论推测NH3分子的空间构型是__________________,其中H—N—H的键角为___________________,请根据价层电子对互斥理论解释其键角小于109°28′的原因:_______。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l) +2N2H4(l)═3N2(g)+4H2O(g) △H=-1038.7kJ·mol﹣1
若该反应中有4mol N—H 键断裂,则形成π 键的数目为__________。
⑶比较氮的简单氢化物与同族第三、四周期元素所形成氢化物的沸点高低并说明理由___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
【答案】C
【解析】①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,说明溶液中含有0.02mol NH4+,同时产生红褐色沉淀为氢氧化铁,说明溶液中含有Fe3+,CO32-与Fe3+会发生双水解而不能大量共存,故溶液中一定不含CO32-;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体为氧化铁,则n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
【题型】单选题
【结束】
8
【题目】根据要求回答下列问题:
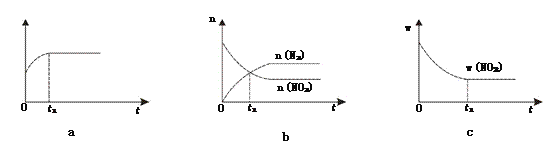
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
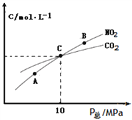
图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
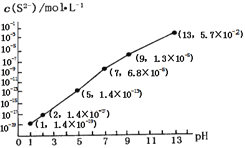
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com