
科目: 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
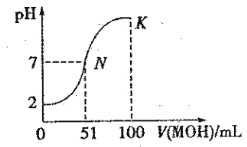
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 。
(2)常温下一定浓度的MA稀溶液的pH = a,则a_________7(填“ > ”、“< ”或“=”),用离子方程式表示其原因:_____________________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:____________________。
(4)K点对应的溶液中,c(M+) +c(MOH)__________2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =_____________mol· L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C是与植物生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质,有机物D也是生活中常见的物质,在一定条件下可发生如下反应:![]() 。它们之间有如图所示的转化关系:
。它们之间有如图所示的转化关系:
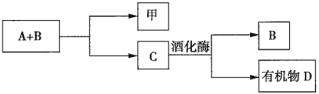
(1)在化合物A、B、C、D中所含元素种类完全相同的是________(填序号,下同)和________。
(2)在常温下,A和B通过________转化为C。该过程中________能转化为________能。
(3)写出由C生成D的化学方程式:________________。
(4)目前化合物B在大气中的含量呈上升趋势,其对环境造成的影响是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以V2O5为原料制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O},其流程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
(1)“还原”过程中的还原剂是____________(填化学式)。
(2)已知VO2+能被O2氧化,“转化”可在如图装置中进行。
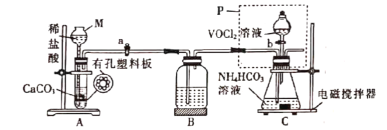
①仪器M的名称是___________,实验开始前的操作是_________。
②装置B的作用是__________________。
③得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用无水乙醇洗涤的目的是_______________。
④称量mg产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为VO2++Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______________(填“偏高”、“偏低”或“无影响”),产品中钒的质量分数为_________(以VO2+的量进行计算,列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成分的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_______(填名称),溶液变蓝,则证明苹果中含有淀粉。
(2)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程图,试回答下列问题:
![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
①写出化学方程式,并注明反应类型。
B与醋酸反应:____________________________,属于______________反应。
B→C____________________________,属于____________________________反应。
②可用于检验A的试剂是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型钙钛矿型太阳能电池以其稳定、高效、便宜和便于制造等优点被科学家所青睐。这种钙钛矿型太阳能电池材料为层状结构。具体如图1所示。

(1)基态Ti原子的电子排布式为____;同周期的基态原子与其未成对电子数相同的元素还有________种。
(2)光敏钙钛矿的晶胞结构如图2所示。
①写出与CH3NH3+互为等电子体的一种分子的化学式:__,C、N、O三种元素的第一电离能由大到小的顺序为____(用元素符号表示),CH3NH3+中含有的化学键类型有____。
②光敏钙钛矿的化学式为________;每个CH3NH3+周围最近且等距离的Br-数目为__。
③若该光敏钙钛矿的摩尔质量为M g·mol-1,晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g.cm-3(用含M、a、NA的代数式表示)。
(3)石墨炔的结构如图3所示,其中碳原子的轨道杂化类型是 _____ ,36 g石墨炔中含有σ键的数目为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①![]() ;
;![]() ;
;
②![]() ,
,![]() ;
;
③![]() ,
,![]() ;
;
1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为________。
(2)已知![]() 的反应历程分两步:
的反应历程分两步:
①![]() (快);
(快);![]() ,
,![]() ;
;
②![]() (慢);
(慢);![]() ,
,![]()
一定温度下,反应![]() 达到平衡状态,该反应的平衡常数的表达式K=____(用
达到平衡状态,该反应的平衡常数的表达式K=____(用![]() 表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
(3)用活性炭还原法处理氮氧化物的有关反应为:![]() 。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
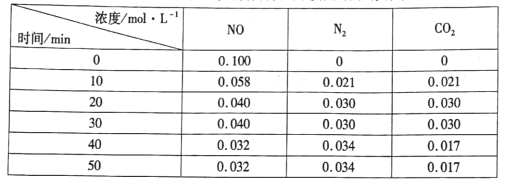
①T℃时,该反应的平衡常数的计算式为______。
②在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是____
③在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(4)反应N2O4(g) ![]() 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:![]() ,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
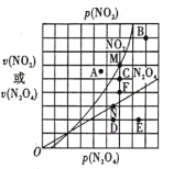
在T℃时,图中M、N点能表示该反应达到平衡状态,理由是___________ 。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为_______(填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_______。
(2)上述反应中的氧化剂是_______,反应产生的气体可用_______吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H++ 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成原电池,则NO2应该在____(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量____(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-![]() H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”),理由是____________________(用离子方程式表示)。
(2)在0.1mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________(填字母)。
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1mol·L-1NaHB溶液的pH=2,0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。下列说法正确的是( )
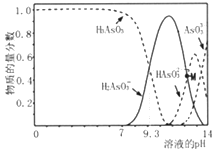
A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )

A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com