
科目: 来源: 题型:
【题目】(1)氨是最重要的氮肥,是产量最大的化工产品之一。在1L密闭容器中,起始投入4mol N2和6mol H2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示 (已知:T1<T2)
温度 | 平衡时NH3的物质的量/mol |
T1 | 3.6 |
T2 | 2 |
①则K1_______K2 (填“>”、“<”或“=”),原因:__________。
②在T2下,经过10s达到化学平衡状态,则平衡时H2的转化率为______________。若再同时增加各物质的量为1mol,则该反应的速率v正_____v逆(>或=或<),平衡常数将______(填“增大”、“减小”或“不变)。
(2)一定温度下,将3mol A气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
①反应1min时测得剩余1.8mol A,C的浓度为0.4 mol/L,则1min内B的反应速率为______,x为_______。
②若混合气体起始压强为P0,10min后达平衡,容器内混合气体总压强为P,用P0、P来表示达平衡时反应物A的转化率a(A)为__________。
③能够说明该反应达到平衡的标志是___________。
A 容器内混合气体的密度保持不变
B v(A)=3v(B)
C A、B的浓度之比为3:1
D 单位时间内消耗3 n molA的同时生成n mol B
E 体系的温度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的叙述中正确的是( )
A.能够使甲基橙变黄的溶液一定为碱性溶液
B.以KI溶液为标准溶液滴定未知浓度的FeCl3溶液,可选用淀粉溶液作为指示剂
C.使用量程为50mL的滴定管测量溶液体积时,开始时读数为21.00mL,将滴定管中剩余液体全部放出,则所得溶液体积大于29.00mL
D.盛待测液的滴定管,第一次读数,平视凹液面最低处,第二次仰视,则所测待测液浓度偏高
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。
(1)在现代化学中,常利用________上的特征谱线来鉴定元素,称为光谱分析。
(2)基态N原子的价电子占据的能量最高的能级是________,价电子在该能级上的排布遵循的原则是_____________。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。lmolNH4BF4含有______mol配位键。
(4)化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。N4比P4的沸点________,原因为_______________________。

(5)尿素(H2NCONH2)也是一种常用的化肥,其分子中原子的杂化轨道类型有________,σ键和π键数目之比为__________。
(6)Cu3N具有良好的电学和光学性能,其晶胞结构如图。Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为________,Cu3N的密度为________g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_____个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________________________________。
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______,微粒之间存在的作用力是_______。
(6)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为________,该晶体中微粒间的作用力是____________。
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为____________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(8) CaC2中C22与O22+互为等电子体,O22+的电子式可表示为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为实验室模拟工业上催化裂化的装置示意图,根据图示回答下列问题。
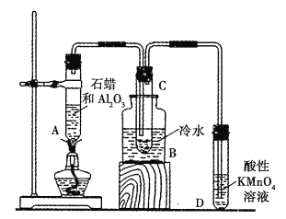
(1)工业上石油裂化的主要目的是_______________________。
(2)A中氧化铝的作用是_____________,B中冷水的作用是___________________。
(3)C中得到的液体具有汽油的气味,该液体________________(填“能”或“不能”,下同)通过化学反应使溴水褪色,而通过石油分馏得到的汽油_______________通过化学反应使溴水褪色。
(4)D中酸性高锰酸钾溶液褪色,说明石蜡裂化时除有液态不饱和烃生成外,还有__________生成。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知海水提取镁的主要步骤如下:
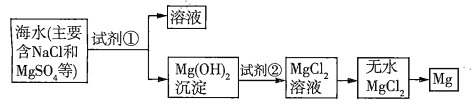
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水,⑤0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液(显碱性)。请根据要求填写下列空白:
(1)溶液①呈____________性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)
(2)在上述①、②、③、④溶液中c(NH4+)浓度由大到小的顺序是_________。(填序号)
(3)在溶液⑤中,各离子浓度大小顺序为___________。
(4)室温下,测得溶液②的pH=7,则 CH3COO—与NH4+浓度的大小关系是c(CH3COO—)________c(NH4+)(填“>”、“<”或“=”)。
(5)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A. c(H+) B. c(H+)/ c(CH3COOH) C. c(H+)·c(OH-)
D. c(OH-)/ c(H+) E. c(H+)·c(CH3COO-) / c(CH3COOH)
(6)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】体积和浓度均为25.00mL0.1mol/LNaI、NaBr及NaCl三种溶液,分别用0.1mol/L的AgNO3溶液滴定,滴定曲线如图所示[pAg=-lgc(Ag+)]。下列说法不正确的是( )
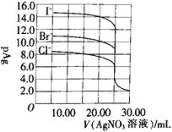
A.Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl)
B.AgNO3溶液滴定Cl-时,可加入少量的KI作滴定指示剂
C.三种溶液等体积等浓度混合后用AgNO3溶液滴定,沉淀顺序为I-、Br-、Cl-
D.当V(AgNO3)=30.00mL时,三种溶液中:c(I-)<c(Br-)<c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com