
科目: 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液。
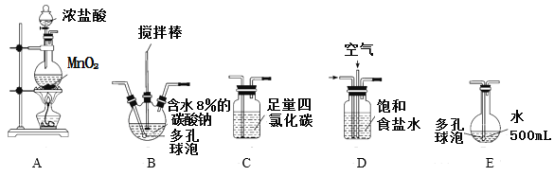
回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置A中反应的离子方程式是__________________________。
(3)实验中控制氯气与空气体积比的方法是_____________________。
(4)反应过程中,装置B需放在冷水中,其目的是_________________________。
(5)装置E采用棕色圆底烧瓶是因为______________________。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为_________g。
(7)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用________________准确量取20.00 mL次氯酸溶液,加入足量的________溶液,再加入足量的________溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目: 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】菱锰矿的主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素。氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
②常温下,CaF2、MgF2的溶度积常数分别为1.46×10-10、 7.42×10-11
回答下列问题:
(1) “焙烧”时发生的主要反应的化学方程式为__________。气体X为________(填化学式),写出它生活中的一种用途_______________。
(2)焙烧时温度对锰浸出率的影响如图所示。焙烧时适应温度为_______________。

(3)浸出液“净化除杂”过程如下:首先用MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变成沉淀除去,溶液的pH的范围为____然后加入NH4F将Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,两种沉淀共存时,溶液中![]() =________(所得结果保留两位小数)。
=________(所得结果保留两位小数)。
(4)碳化结晶的原理(用离子方程式表示): ______________________。
(5)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为_________。
(6)在该工艺流程中可以循环使用的物质有__________。(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变
B.NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强
C.SO3(g)+H2O(l)=H2SO4(aq)在常温下能自发进行,则该反应的△H<0
D.0.1 mo1·L-1CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
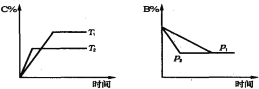
A. T1>T2,正反应放热
B. Tl<T2,正反应吸热
C. P1>P2,a+b>c+d
D. Pl<P2,b=c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。

已知:I.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp [Mn(OH)2]=4.0×10-14
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有_____、“气体”除水蒸气、HCl外还有____(均填化学式);
(2)过程①中MnWO4参与反应的化学方程式为______;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为___________;
(3)已知WO3(s)+3H2(g)=W(s)+3H2O(g) ΔH=a kJ·mol-1
WO3(s)=WO3(g) ΔH=b kJ·mol-1
写出WO3(g)与H2(g)反应生成W(s)的热化学方程式:_______;
(4)过程⑦在25℃时调pH,至少应调至_______(当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全);
(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是__________;
(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0<x<1,这类化合物具有特殊的物理化学性质,是一种低温超导体。应用惰性电极电解熔融的Na2WO4和WO2混合物可以制备钠钨青铜,写出WO42-在阴极上放电的电极反应式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
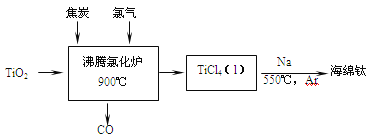
(1)TiCl4遇水强烈水解,写出其水解的化学方程式___________________。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是___________。
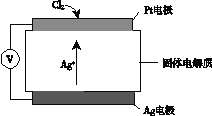
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为_______。
③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为____mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K=_____________。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是___________(填序号)。
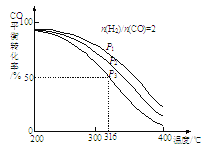
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
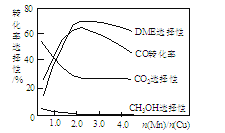
催化剂中n(Mn)/n(Cu)约为___________时最有利于二甲醚的合成。
查看答案和解析>>
科目: 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO47H2O晶体,其流程图如下:
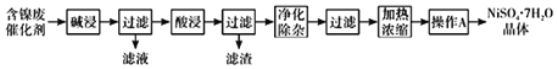
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为______。
(2)“酸浸”所使用的酸为______。
(3)“净化除杂”需加入H2O2溶液,其作用是______。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。______
(4)“操作A”为______、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为______。
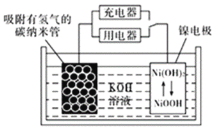
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com