
科目: 来源: 题型:
【题目】某化学小组拟设计实验探究SO2与钙盐溶液的反应情况。
(文献资料)
①CaSO3是难溶于水、易溶于盐酸的白色固体;
②实验室用Na2SO3粉末和80%硫酸反应制备SO2;
③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
(设计实验)
实验Ⅰ:探究二氧化硫与氯化钙溶液反应。
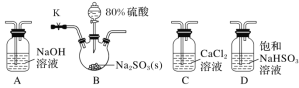
(1)若气体从左至右流动,选择装置并排序为________(填代号)。
(2)D装置作用是___________________________________________
(用离子方程式表示)。
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色固体是CaSO3;
假设2:白色固体是CaSO4;
假设3:白色固体是CaSO4和CaSO3。
②乙同学设计实验证明白色沉淀是CaSO4,他的实验方案是_____________________________________。
③丙同学认为C中生成硫酸钙的原因是装置内O2氧化了SO2。
排除装置内O2干扰采取的措施是:在启动B中反应之前,____________(填实验步骤)
重新实验,C中无明显现象,所以SO2和CaCl2溶液不反应。
实验Ⅱ:探究SO2和Ca(ClO)2溶液反应。
丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
①若SO2过量,则发生反应为Ca(ClO)2+2SO2+2H2O===CaSO4↓+2HCl+H2SO4
②若SO2少量,则发生反应为_____________________________________________________。
(5)为了探究C中SO2是否过量,戊同学取少量C中上层清液于试管中,加入下列物质可以达到实验目的的是________(填字母)。
a.NaHCO3溶液 b.品红溶液
c.AgNO3溶液 d.紫色石蕊溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机反应的化学方程式书写正确是
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.![]()
C.CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+ H2O
CH3COOCH2CH3+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式正确的是
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B. 碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
C. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】从有机化合物 A 出发,在一定条件下,可发生如下图一系列转化(部分反应的条件已略去):

已知:B、D 互为同分异构体。
(1)B 的结构简式是_________。
(2)B→C 的反应类型是 ______。
(3)G 中官能团名称_________。
(4)D→E 反应的化学方程式为_______。
(5)写出同时满足下列条件的 C 的一种同分异构体的结构简式:__________。
①能发生银镜反应但不能水解;②苯环上的一氯代物只有两种。
(6)已知:![]() ,(R、R’可以是烃基或H),写出以
,(R、R’可以是烃基或H),写出以![]() 为原料合成“物质 A”的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______
为原料合成“物质 A”的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______
查看答案和解析>>
科目: 来源: 题型:
【题目】某高分子化合物 F 的合成路线如下:
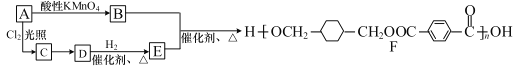
(1)A 的分子式为 C8H10,则 A、E 的结构简式分别是_________、_________。
(2)A→B 的反应类型是_________。
(3)写出 C→D 的反应方程式:_________ 。
(4)H 是 E 的一种同分异构体,其分子中含有 3 种不同化学环境的氢,能使溴水褪色,1mol 该分子最多与 2 mol Na 反应,写出符合条件的 H 结构简式_________任写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
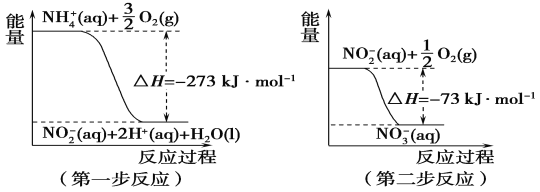
①第一步反应是________(填“放热”或“吸热”)反应。
②1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式:__________________。
(2)在298 K、101 kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1;
Cl2(g)+H2(g)=2HCl(g) ΔH2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3。
则ΔH3与ΔH1和ΔH2之间的关系正确的是___________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(3)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1_________ΔH2(填“>”、“<”或“=”)。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1 ②1∶1∶2 ∶6 ③3∶2 ④3∶2∶2∶2∶1 ,请分别推断出其对应的结构:
①_______________________________; ②______________________________;
③_______________________________; ④______________________________。
(2)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
试剂:①水; ②氢氧化钠; ③溴水; ④酸性高锰酸钾
分离装置:A.分液装置; B.蒸馏装置; C.洗气装置;
需加入的试剂 | 分离装置 | |
乙烷(乙烯) | __________________ | __________________ |
乙醇(乙酸) | __________________ | __________________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使石蕊试液显蓝色的溶液:Na+、Al3+、NO![]() 、SO
、SO![]()
B.能使甲基橙显红色的溶液:Mg2+、K+、HCO![]() 、Cl-
、Cl-
C.c(NaCl)=0.1 mol·L-1的溶液:NH![]() 、Ca2+、NO
、Ca2+、NO![]() 、Br-
、Br-
D.KW/c(OH-)=0.1 mol·L-1的溶液:Na+、Fe2+、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】合成药物X、Y和高聚物Z,可以用烃A为主要原料,采用以下路线:
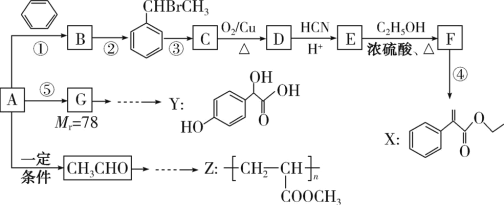
已知:I.反应①、反应②均为加成反应
II. 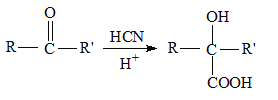 (R和R' 可以是烃基或H原子)请回答下列问题:
(R和R' 可以是烃基或H原子)请回答下列问题:
(1)CH3CHO分子中碳原子的杂化方式为_______________,CH3CH2OH的沸点明显高于CH3CHO的原因是________________________。
(2)A的名称为________________,X的分子式为________________________。
(3)关于药物Y(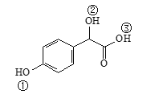 )中①、②、③ 3个-OH的酸性由弱到强的顺序是____________________。
)中①、②、③ 3个-OH的酸性由弱到强的顺序是____________________。
(4)写出反应C→D的化学方程式:___________。E→F的化学方程式: ____________。
(5)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选设计合成Z的路线流程图:_____________________。合成路线流程图示例:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CH2Br
CH3CH2Br
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂。但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致。亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体![]() 、
、![]() 用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
![]() 实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到
实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到![]() 酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
![]() 写出氮氧化物
写出氮氧化物![]() 、
、![]() 与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用
与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用![]() 溶液吸收
溶液吸收![]() 可生成
可生成![]() ,
,![]() 和
和![]() 溶液完全反应时转移电子
溶液完全反应时转移电子![]() ,则反应的离子方程式为 ______ 。
,则反应的离子方程式为 ______ 。
![]() 从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
A.稀盐酸![]() 溶液
溶液![]() 稀硝酸
稀硝酸![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______
等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______ ![]() 填溶液中溶质的化学式
填溶液中溶质的化学式![]() 。
。
![]() 工业品硝酸钠含少量杂质
工业品硝酸钠含少量杂质![]() 、
、![]() 、NaCl、水不溶物
、NaCl、水不溶物![]() ,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
![]() 称取
称取![]() 干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL
干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL![]() 的A溶液
的A溶液![]() 足量
足量![]() ,充分反应后过滤;
,充分反应后过滤;
![]() 向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
![]() 取
取![]() 所配溶液于锥形瓶中,加入少量B物质,再用
所配溶液于锥形瓶中,加入少量B物质,再用![]() 的
的![]() 溶液滴定,用去
溶液滴定,用去![]() 溶液
溶液![]() 。
。
(有关反应为:![]()
![]() 溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
![]() 物质是 ______ ,滴定终点时的颜色变化是 ______ 。
物质是 ______ ,滴定终点时的颜色变化是 ______ 。
![]() 若该同学操作正确,但结果造成测定结果略偏高,其原因可能是
若该同学操作正确,但结果造成测定结果略偏高,其原因可能是![]() 任写一点
任写一点![]() ______ 。
______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com