
科目: 来源: 题型:
【题目】将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求完成下列每一小题
(1)根据系统命名法,![]() 的名称是___;
的名称是___;
(2)根据系统命名法![]() 的名称是___;
的名称是___;
(3)根据系统命名法 的名称是___;
的名称是___;
(4) 核磁共振氢谱吸收峰面积之比是___。
核磁共振氢谱吸收峰面积之比是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
![]() 溶液B经过________、__________、___________可得到氯化铜晶体;
溶液B经过________、__________、___________可得到氯化铜晶体;
![]() 检验溶液B中是否存在
检验溶液B中是否存在![]() 的方法是_________;
的方法是_________;
![]() 下列物质适合于调节溶液的pH得溶液B的是________
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液 ![]()
![]() 氨水
氨水 ![]()
![]() 已知元素在高价态时常表现氧化性,若在酸性
已知元素在高价态时常表现氧化性,若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
(1)①钢铁在海水中容易发生电化学腐蚀,正极反应式是__________。
②图中,为减缓钢闸门的腐蚀,材料B可以选择__________(填“Zn”或“Cu”)。
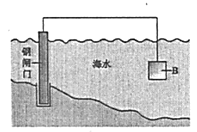
(2)如图为钢铁防护模拟实验装置,则铁做__________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,_________,则说明保护效果好。

(3)氢氧燃料电池是一种新型的化学电源,其构造如图所示:

a、b为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①a的电极反应式是_________;
②若电池共产生3.6g水,则电路中通过了_______mol的电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应可表示为:![]() ,“水”电池在放电时:
,“水”电池在放电时:
(1)该电池的负极的电极反应式为__________________________
(2)![]() 不断向“水”电池的_________极移动
不断向“水”电池的_________极移动
(3)每有![]() 电子转移,生成_________
电子转移,生成_________![]()
(4)将该“水”电池与如图所示的装置相连

![]() 、Y为石墨,a为2L一定物质的量浓度的KCl溶液,电解一段时间发现Y极附近产生了黄绿色气体,写出电解总反应的化学方程式_____________.
、Y为石墨,a为2L一定物质的量浓度的KCl溶液,电解一段时间发现Y极附近产生了黄绿色气体,写出电解总反应的化学方程式_____________.
![]() 、Y分别为铁、铜,a为
、Y分别为铁、铜,a为![]() 和
和![]() 的混合溶液,电池与X、Y的连接方式与
的混合溶液,电池与X、Y的连接方式与![]() 相同,Y极的电极反应式为 ____________.
相同,Y极的电极反应式为 ____________.
(5)室温时,取上述![]() 中
中![]() 电解一段时间后的溶液,除去其中的
电解一段时间后的溶液,除去其中的![]() 且不引入新的杂质
且不引入新的杂质![]() 得到溶液甲,将甲溶液逐滴加入到20ml等物质的量浓度的醋酸中,得到如图
得到溶液甲,将甲溶液逐滴加入到20ml等物质的量浓度的醋酸中,得到如图![]() 不考虑能量损失和气体溶于水,溶液体积变化忽略不计
不考虑能量损失和气体溶于水,溶液体积变化忽略不计![]()

![]() 醋酸的电离平衡常数:C点________B点
醋酸的电离平衡常数:C点________B点![]() 填“
填“![]() ”,“
”,“![]() ”或“
”或“![]() ”
” ![]()
![]() 点溶液中的溶质是:_____________
点溶液中的溶质是:_____________![]() 填化学式
填化学式![]()
![]() 图中,从A点到D点的下列有关说法正确的是______________
图中,从A点到D点的下列有关说法正确的是______________![]() 填字母
填字母![]()
![]() 点时测得溶液中水电离的
点时测得溶液中水电离的![]() 浓度为
浓度为![]() ,则原醋酸溶液的浓度为
,则原醋酸溶液的浓度为![]()
![]() 点时,
点时,![]()
![]() 点时,已知
点时,已知![]() 的
的![]() 大于
大于![]() 的
的![]() ,则溶液中离子浓度的大小关系为:
,则溶液中离子浓度的大小关系为:![]()
![]() 点的溶液
点的溶液![]() 冷却至室温
冷却至室温![]() 等于7
等于7
查看答案和解析>>
科目: 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充电时阳极反应为___。
⑵放电时负极反应为___。
⑶放电过程中OH-通过隔膜从区移向___。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的![]() ,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用
,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用![]() 外,还能得到一种复合肥料。
外,还能得到一种复合肥料。
(1)①若氨水与![]() 恰好完全反应生成正盐,则此时溶液呈________性
恰好完全反应生成正盐,则此时溶液呈________性![]() 填“酸”或“碱”
填“酸”或“碱”![]() 。常温下弱电解质的电离平衡常数如下:氨水
。常温下弱电解质的电离平衡常数如下:氨水![]()
![]() 溶液中通入________气体可使溶液呈中性。
溶液中通入________气体可使溶液呈中性。![]() 填“
填“![]() ”或
”或![]() ”
”![]() 此时溶液中
此时溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
(2)向![]() 溶液通入过量
溶液通入过量![]() ,充分反应后所得溶液中离子浓度大小顺序为________________。
,充分反应后所得溶液中离子浓度大小顺序为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)石墨电极(C)作___极,丙池中滴有酚酞,实验开始后观察到的现象是_____,甲中甲烷燃料电池的负极反应式为________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为___ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______。
A.b电极为粗铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________。
(5)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将_______,(填“增大”“减小”或“不变”),且变化了_____克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com