
科目: 来源: 题型:
【题目】某温度时,在 2 L 的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。
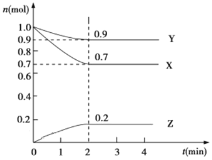
(1)反应从开始至 2 分钟末,Y 的转化率为α(Y)=_______________。
(2)由图中所给数据进行分析,该反应的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2NA
B. 71g氯气通入足量的水中,反应中转移的电子总数为NA
C. 由D和18O所组成的水11g,所含的中子数为4NA
D. 1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
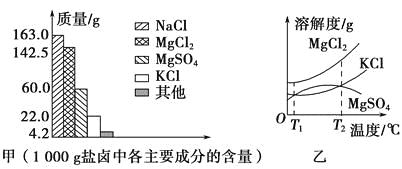
【题目】我国拥有很长的海岸线,具有丰富的海洋资源,以海水为原料的盐化工是我国重要的产业。盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如下图甲)。盐卤在食品、化工等方面具有广泛的用途。请解答下列与盐卤有关的试题。
(1)根据图甲,写出盐卤中含量最多的两种盐的化学式:_______、_______。
(2)下图乙是盐卤中某些物质的溶解度曲线,已知T1℃时,MgSO4和KCl的溶解度分别为M、N,则它们溶解度大小的关系为_______;将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是______________________________________________________。
(3)化工厂利用卤水生产金属镁的工艺流程如下:
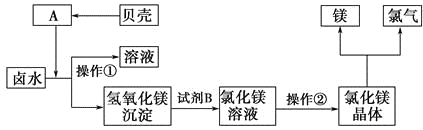
“操作①”的目的是将氢氧化镁沉淀分离出来,操作①的名称是_______。氢氧化镁与试剂B反应的化学方程式为______________________________。
操作②的名称是_______。该方法的优点为___________________________。
(4)用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中同学_______(填“甲”或“乙”)能够成功地制备金属镁,假设生产过程中镁元素没有损失,则100 g卤水可制备镁_______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
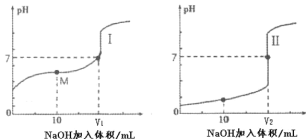
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验:

下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、![]() 和
和![]() 一定存在于溶液X中
一定存在于溶液X中
D.![]() 和
和![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目: 来源: 题型:
【题目】图 a 是 1 mol NO2 和 1 mol CO 恰好反应生成 CO2 和 NO 过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的 NO2 和 CO,反应中的 CO 和 NO 的浓度随时间变化的示意图如 b 图。根据图意回答下列问题:
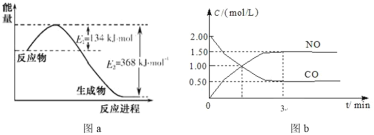
(1)写出 NO2 和CO 反应的热化学方程式__________。
(2)从反应开始到平衡,用 NO2 浓度变化表示平均反应速率 v(NO2)=_________。
(3)此温度下达到平衡时 NO2 的转化率为_________。
(4)830K 时,在密闭容器中发生下列可逆反应CO(g)+H2O(g)CO2(g)+H2(g) △H<0。试回答下列问题:
①若起始时 c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时 CO 的转化率为 60%,则在该温度下,该反应的平衡常数 K=__。
②在相同温度下,若起始时 c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得 H2 的浓度为 0.5mol·L-1,则此时该反应______(填“是”与“否”)达到平衡状态,此时 v(正)_____v(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验方案能达到实验目的的是
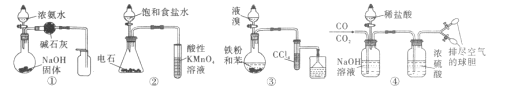
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
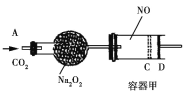
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中的操作,对应的现象以及结论都正确的是![]()
![]()
选项 | 操作 | 现象 | 结论 |
A | 向 | 产生白色沉淀 |
|
B | 蘸有浓氨水的玻璃捧靠近X | 有白烟产生 | X一定是浓盐酸 |
C | 向澄清石灰水加入某试剂的溶液少许 | 产生白色沉淀 | 该试剂中一定含有 |
D | 炭粉中加入浓硫酸并加热,导出的气体通入 | 有白色沉淀产生 | 有 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com