
科目: 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图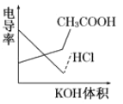 。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
A.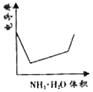 B.
B.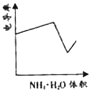 C.
C.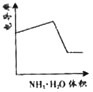 D.
D.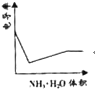
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.10 mol/L的氨水滴定10.0 mLa mol/L的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是( )
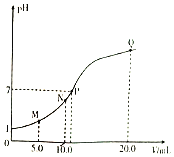
A.a=0.10
B.N、P两点溶液中水的电离程度:N<P
C.M、N两点溶液中NH4+的物质的量之比大于1:2
D.Q点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将淀粉水解并用新制Cu(OH)2悬浊液检验水解产物的实验中,要进行的主要操作有:①加热;②滴入稀硫酸;③加入新制的Cu(OH)2悬浊液;④加入NaOH溶液中和。以上各步操作的先后顺序排列正确的是________。
A.②③④① B.②④③① C.②①④③ D.④③②①
(2)若某学生称取9g淀粉溶于水,按以下步骤做淀粉水解实验,回答下列问题。

①写出淀粉水解的化学方程式:________________。
②沉淀的单质是________________(写化学式)。
③填写所加试剂名称及其作用:
A________,作用________________________________;
B________,作用________________________________。
④当析出3.24g单质沉淀时,淀粉的水解率为________(已知1mol醛基发生银镜反应时生成2molAg)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了检验淀粉的水解情况,某同学设计了以下个实验方案,并根据实验现象,得出了相应的结论。
方案价甲:淀粉溶液![]() 水解液
水解液![]() 溶液变为蓝色
溶液变为蓝色
结论:淀粉未水解
方案乙:淀粉溶液![]() 水解液
水解液![]() 无砖红色沉淀生成
无砖红色沉淀生成
结论:淀粉未水解
方案丙:淀粉溶液![]() 水解液
水解液![]() 中和液
中和液![]() 有银镜现象
有银镜现象
结论:淀粉已经水解完全
根据上述操作及现象首先回答结论是否正确,然后简要说明理由。如果三个方案均不合理,请另设计一个方案来证明淀粉已经水解完全。
(1)方案甲:________________________________________________。
(2)方案乙:________________________________________________。
(3)方案丙:________________________________________________。
(4)你的方案:________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为_______________________________。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是_______________________________(填字母序 号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)Ⅰ.两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠。实验室现有醋酸钠固体,取少量溶于水,溶液呈_______________________________(选填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)_______________________________。
Ⅱ.用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
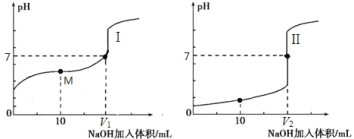
①滴定醋酸的曲线是_______________________________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的 c(H+)最大的是_______________________________。
③ V1 和 V2 的关系:V1_______________________________V2(填“>”、“=”或“<”)。
④ M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________________________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。 资料:AgSCN 是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤 1:向 2 mL 0.005 mol·L-1 AgNO3 溶液中加入 2 mL 0.005 mol·L-1 KSCN 溶液,静置。 | 出现白色沉淀。 |
步骤 2:取 1 mL 上层清液于试管中,滴加 1 滴 2 mol·L-1Fe(NO3)3 溶液。 | 溶液变红色。 |
步骤 3:向步骤 2 的溶液中,继续加入 5 滴 3 mol·L-1 AgNO3溶液。 | 现象 a ,溶液红色变浅。 |
步骤 4:向步骤 1 余下的浊液中加入 5 滴 3 mol·L-1 KI 溶液。 | 白色沉淀转化成黄色沉淀。 |
① 写出步骤 2 中溶液变红色的离子方程式_____。
② 步骤 3 中现象 a 是_____。
③ 用化学平衡原理解释步骤 4 的实验现象_____。
(4)某小组模拟工业上回收分银渣中的银,过程如下:
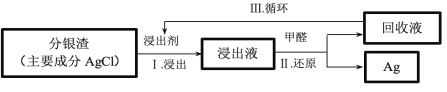
过程 I 的主要反应:AgCl+2![]()
![]()
![]() +Cl-
+Cl-
过程 II 的离子反应:4![]() +6OH- +HCHO=4Ag++8
+6OH- +HCHO=4Ag++8![]() +4H2O+
+4H2O+![]()
Ⅲ中回收液可直接循环使用,但循环多次后,I 中的银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20ml0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示。则下列说法正确的是( )
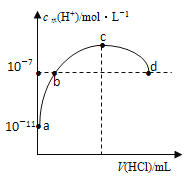
A.b、d两点为恰好完全反应点
B.c点溶液中c(NH4+)=c(Cl-)
C.a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】将镁条置于 pH=8.4 的饱和 NaHCO3 溶液中,镁条表面产生气体 a,一段时间后产生白色沉淀b。继续进行如下实验:
Ⅰ.将 a 通过澄清石灰水,变浑浊,继而通过足量 NaOH 溶液,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声;
Ⅱ.向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡。下列说法不正确的是
A.饱和 NaHCO3 溶液中,c(![]() )< c(H2CO3)
)< c(H2CO3)
B.沉淀 b 是 MgCO3
C.气体 a 中含有 CO2 和 H2
D.CO2 可能是 ![]() 水解被促进产生的
水解被促进产生的
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将1.0 mol/L 盐酸滴入20 mL 1.0 mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如图所示。下列有关说法正确的是( )
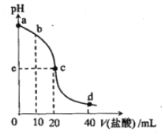
A.a点,c(NH4+)=c(OH-)
B.b点,c(NH4+)>c(Cl-)>c(NH3·H2O)
C.c点,pH=7
D.d点,c(NH4+)+c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
A.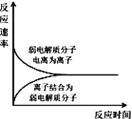 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程
B.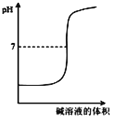 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线
C.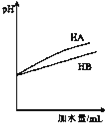 表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D.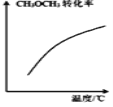 表示密闭容器中
表示密闭容器中![]() 达到平衡后,恒压升高温度过程中,
达到平衡后,恒压升高温度过程中,![]() 的转化率变化趋势
的转化率变化趋势
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是
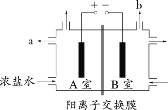
A.粗盐水中含有的少量 Ca2+和 Mg2+均可用 NaOH 除去
B.若电路中通过 0.2 mol 电子,理论上可在 b 处得到标准状况下 1.12 L 气体
C.a 处得到的是浓 NaOH 溶液
D.适当降低阳极电解液的 pH 有利于 Cl2 逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com