
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是( )
①Na![]() Na2O2
Na2O2![]() Na2CO3
Na2CO3
②MgO![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
③Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
④SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
⑤HCHO![]() HCOOH
HCOOH![]() HCOOCH3
HCOOCH3
A.①②③B.②③④C.②③⑤D.①④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】对于密闭容器中的反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是
2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是

A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d (t1时刻)和点e (t2时刻)处n(SO2)不一样
D.其他条件不变,600℃时反应至t1时刻,n(SO 3)比上图中的e点值要大
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
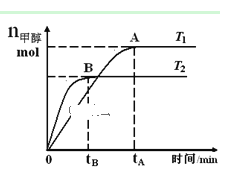
A.平衡常数K =![]()
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
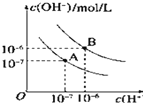
(1)95℃时,0.01mol/LNaOH溶液的pH=________________________________________
(2)95℃时水的电离平衡曲线应为_________(填“A”或“B”),请说明理由___________
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__________________________________________
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________
(5)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因:___________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】用硼镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 和
和![]() 制取粗硼的工艺流程为:
制取粗硼的工艺流程为:
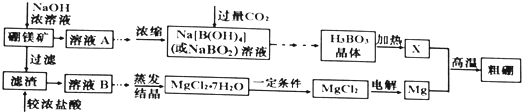
已知:![]() 硼与铝的性质相似,也能与氢氧化钠溶液反应.
硼与铝的性质相似,也能与氢氧化钠溶液反应.
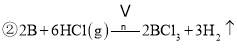
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,在潮湿空气中易形成白雾.
,在潮湿空气中易形成白雾.
I.回答下列问题:
![]() 证明溶液B中含有铁元素的方法是 ______
证明溶液B中含有铁元素的方法是 ______
![]() 与X反应制取粗硼的化学方程式 ______
与X反应制取粗硼的化学方程式 ______
![]() 上图中制取
上图中制取![]() 的“一定条件”是指 ______
的“一定条件”是指 ______
![]() 某同学设计如图所示装置制备三氯化硼.
某同学设计如图所示装置制备三氯化硼.

回答下列问题:
![]() 装置的作用是 ______ .
装置的作用是 ______ .
![]() 如果去掉B装置,可能的后果是 ______ .
如果去掉B装置,可能的后果是 ______ .

![]() 装置后面还应连接的一个装置是 ______ .
装置后面还应连接的一个装置是 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化锡常用作媒染剂、有机合成中的催化剂,已知SnCl4易水解,溶点为-33℃、沸电为114℃。某研究性学习小组设计如图装置(部分夹持装置及加热仪器省略)制备SnCl4。
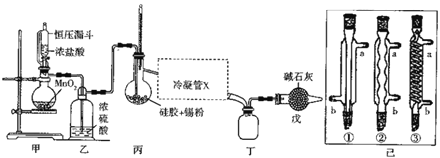
(1)装置甲中反应的离子方程式为___。整个制备装置中有一处不足,改进的方法是___。
(2)利用改进后的装置进行实验(下同)时甲、丙均需加热,首先加热的是___处的烧瓶,冷凝管x是已中的一种,该仪器的编号是___,装置戊的用途是___。
(3)实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是___。
(4)该小组的甲同学提出,可利用标准NaOH溶液滴定甲中剩余溶液的方法测定出盐酸与MnO2反应的最低浓度。
①滴定时所用指示剂最好是___[假设开始出现Mn(OH)2,沉淀时的pH约为6.8]。
②假设实验时从甲中准确取出V2 mL剰余溶液并稀释到V3mL,然后用0.1000molL-1的 NaOH溶液进行滴定,滴定终点时消耗掉V1 mLNaOH溶液,则盐酸与MnO2反应时最低浓度应大于___。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物 Z 的结构简式为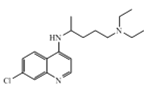 ,常进一步修饰后制成注射液使用,也可制成口服剂。如图为化合物 Z 的一种合成路线,先分别合成化合物F和Y,最后再用F 和 Y 反应获得化合物Z。
,常进一步修饰后制成注射液使用,也可制成口服剂。如图为化合物 Z 的一种合成路线,先分别合成化合物F和Y,最后再用F 和 Y 反应获得化合物Z。
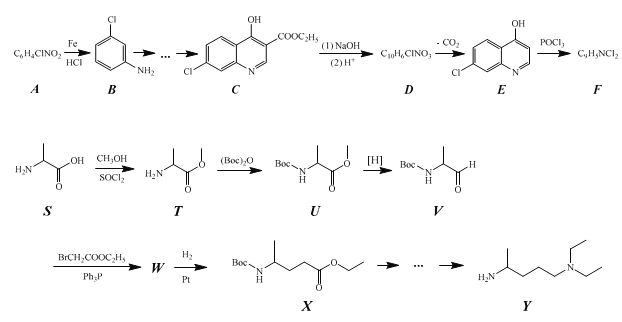
已知:
①![]()
![]()
![]()
②(Boc)2O=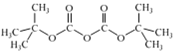 (其中Boc=
(其中Boc=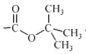 ,作答时建议用缩写符号来表示)
,作答时建议用缩写符号来表示)
③Ph3P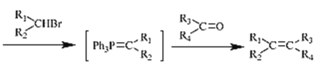 (其中-Ph为苯基,不考虑顺反异构)
(其中-Ph为苯基,不考虑顺反异构)
(1)化合物A 中含氧官能团的名称为__。
(2)生成化合物B的反应类型为__,由化合物F 和 Y 合成化合物Z 的反应类型为__。
(3)化合物C与足量NaOH水溶液反应,即化合物C到化合物D的转化步骤(1)的化学方程式为__。
(4)由化合物T到化合物U的反应还生成了CO2和一种醇,请写出这个醇的结构简式__。将化合物T与(Boc)2O反应制成化合物U再进行后续反应的目的是__。
(5)化合物W 的结构简式为__。
(6)作为药物时,化合物 Z 往往要进一步与磷酸反应制成磷酸盐使用。这么做的原因是:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】以明矾![]() 为原料制备Al、
为原料制备Al、![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
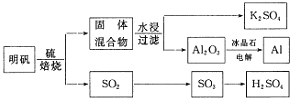
依据上述流程图回答下列问题:
![]() 写出明矾和硫单质混合焙烧发生反应的化学方程式______.
写出明矾和硫单质混合焙烧发生反应的化学方程式______.
![]() 从水浸后的滤液中得到
从水浸后的滤液中得到![]() 晶体的方法是蒸发浓缩、______、过滤,实验室在蒸发浓缩过程中用到的主要仪器有______.
晶体的方法是蒸发浓缩、______、过滤,实验室在蒸发浓缩过程中用到的主要仪器有______.
![]() 电解
电解![]() 时加入冰晶石的作用是______.
时加入冰晶石的作用是______.
![]() 以Al和
以Al和![]() 为电极,NaOH溶液为电解液组成一种新型电池,放电时
为电极,NaOH溶液为电解液组成一种新型电池,放电时![]() 转化为
转化为![]() ,该电池反应的化学方程式是______.
,该电池反应的化学方程式是______.
![]() 焙烧产生的
焙烧产生的![]() 可用于制硫酸.已知
可用于制硫酸.已知![]() ,101kPa时:
,101kPa时:
![]()
![]()
![]()
则![]() 和
和![]() 反应的热化学方程式是______.
反应的热化学方程式是______.
![]() 焙烧948吨明矾
焙烧948吨明矾![]() ,若
,若![]() 的利用率为
的利用率为![]() ,则可生产多少吨质量分数为
,则可生产多少吨质量分数为![]() 的硫酸?
的硫酸?
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学实验事实及其解释都正确的是( )
A. 过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜 可直接与1 mol/L稀硫酸反应
B. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C. 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面 形成了一层致密稳定的氧化膜
D. 工业制玻璃的主要反应之一:Na2CO3+SiO2高温Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
查看答案和解析>>
科目: 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。某热再生浓差电池工作原理如图所示,通入NH3时电池开始工作,左侧电极质量减少,右侧电极质量增加,中间A为阴离子交换膜,放电后可利用废热进行充电再生。已知:Cu2++4NH3![]()
![]() ,下列说法不正确的是
,下列说法不正确的是
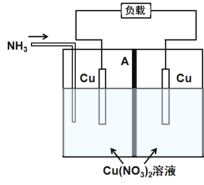
A.放电时,左侧电极发生氧化反应:Cu+4NH3-2e=![]()
B.放电时,电池的总反应为Cu2++4NH3![]()
![]() ,ΔH>0
,ΔH>0
C.放电时,![]() 经离子交换膜由右侧向左侧迁移
经离子交换膜由右侧向左侧迁移
D.上述原电池的形成说明,相同条件下,![]() 的氧化性比Cu2+的氧化性弱
的氧化性比Cu2+的氧化性弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com