
科目: 来源: 题型:
【题目】在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 ![]() 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应:![]()
![]() ,一段时间后达到平衡。反应过程中测定的数据如下表:
,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前 ![]() 的平均速率
的平均速率 ![]()
B.该温度下此反应的平衡常数 ![]()
C.其他条件不变,再充入 ![]() Z ,平衡时 X 的体积分数不变
Z ,平衡时 X 的体积分数不变
D.其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)
查看答案和解析>>
科目: 来源: 题型:
【题目】在120 ℃时,以任意质量比混合的某烃的混合物和过量 O2 在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是( )
A.CH4和C2H4B.CH4和C2H6C.C2H4和C2H6D.C2H2和C3H6
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:氯酸钾能氧化Ag、Zn等金属。从一种银矿![]() 含Ag、Zn、Cu、Pb及少量
含Ag、Zn、Cu、Pb及少量![]() 中提取Ag、Cu及Pb的工艺流程如下:
中提取Ag、Cu及Pb的工艺流程如下:
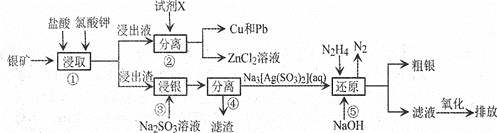
![]() 步骤
步骤![]() 提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________
提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________![]() 写出两种即可
写出两种即可![]() 。
。
![]() 步骤
步骤![]() 试剂X为________
试剂X为________![]() 填化学式,下同
填化学式,下同![]() ;步骤
;步骤![]() 滤渣的成分为________。
滤渣的成分为________。
![]() 步骤
步骤![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
![]() 步骤
步骤![]() 发生反应的离子方程式为________;其中
发生反应的离子方程式为________;其中![]() 肼
肼![]() 的电子式为________。
的电子式为________。
![]() 还原后的“滤液”经氧化后,其中的溶质为________。
还原后的“滤液”经氧化后,其中的溶质为________。
![]() 粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+ CO(g)=HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如右图所示。下列说法不正确的是
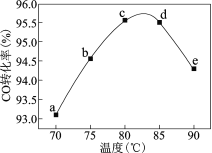
A.增大压强甲醇转化率增大
B.b点反应速率υ正 = υ逆
C.平衡常数K(75℃)>K(85℃),反应速率υb<υd
D.生产时反应温度控制在80~85℃为宜
查看答案和解析>>
科目: 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )


图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】在某一容积为2 L的密闭容器中,加入0.8 mol的H2和0.6 mol 的I2,在一定的条件下发生如下反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0反应中各物质的浓度随时间变化情况如图:
2HI(g) ΔH<0反应中各物质的浓度随时间变化情况如图:
(1)根据如图数据,反应开始至达到平衡时,平均速率v(HI)为________。
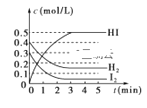
(2)反应达到平衡后,第8 min时:①若升高温度,化学平衡常数K________(填“增大”、“减小”或“不变”),HI浓度的变化正确的是________(用如图中a~c的编号回答)。
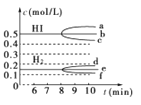
②若加入I2,H2浓度的变化正确的是________(用如图中d~f的编号回答)。
(3)反应达到平衡后,第8 min时,若反应容器的容积扩大一倍,请在图中画出8 min后HI浓度的变化情况。
 ______
______
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
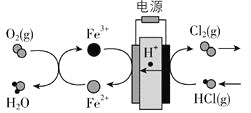
负极区发生的反应有_________![]() 写反应方程式
写反应方程式![]() 。电路中转移
。电路中转移![]() 电子,需消耗氧气__________
电子,需消耗氧气__________![]() 标准状况
标准状况![]() 。
。
![]() 电解法转化
电解法转化![]() 可实现
可实现![]() 资源化利用。电解
资源化利用。电解![]() 制HCOOH的原理示意图如下。
制HCOOH的原理示意图如下。

![]() 写出阴极
写出阴极![]() 还原为
还原为![]() 的电极反应式:________。
的电极反应式:________。
![]() 电解一段时间后,阳极区的
电解一段时间后,阳极区的![]() 溶液浓度降低,其原因是_____。
溶液浓度降低,其原因是_____。
![]() 可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接
可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接![]() 或
或![]() ,可交替得到
,可交替得到![]() 和
和![]() 。
。
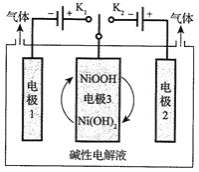
![]() 制
制![]() 时,连接_______________。产生
时,连接_______________。产生![]() 的电极反应式是_________。
的电极反应式是_________。
![]() 改变开关连接方式,可得
改变开关连接方式,可得![]() 。
。
![]() 结合
结合![]() 和
和![]() 中电极3的电极反应式,说明电极3的作用:___________。
中电极3的电极反应式,说明电极3的作用:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目: 来源: 题型:
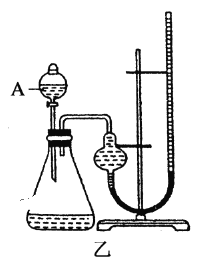
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题。
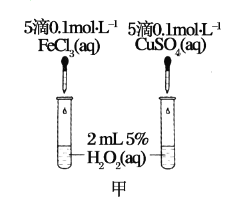
(1)定性如图甲可通过观察_______________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________。
(2)定量如图乙所示,实验时均以生成20mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是________,为了减少实验误差,反应前后量气管两边液面的高度应保持一致,则在反应后应采取的操作方法是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com