
科目: 来源: 题型:
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下:

已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中溶解度不大,易溶于MIBK。
(1)锆英石中锆元素的化合价为____________。
(2)氯化主反应:ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。
ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。

(3)写出A12O3高温氯化过程中转化为AlC13的化学方程式___________________;
(4)Na2S、H2S、NaCN等均为常用的铜沉淀剂,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________(用离子方程式解释)。若盐酸溶解后溶液中c(Cu2+)=0.01mol/L,当溶液中Cu2+开始沉淀时,c(CN-)= ___________。(已知Ksp[Cu(CN)2]=4.00×10-10)
(5)实验室进行萃取和反萃取的仪器是_______。流程中萃取与反萃取的目的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于如图所示各装置的叙述正确的是

A.装置①是原电池,总反应式是Cu+2Fe3+= Cu2++2Fe2+
B.装置①中,铁作正极,正极反应式为Fe3++e-= Fe2+
C.装置②可以减缓铁棒的腐蚀,此保护方法为牺牲阳极的阴极保护法
D.若用装置③精炼铜,则c极为粗铜,d极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Fe、Fe2O3和CuO的混合粉末加入到100mL 4.4mol/L 的盐酸中,充分反应后,充分反应后,生成标准状况下的氢气896mL。过滤,滤渣经洗涤、干燥后称量,质量为1.28g。滤液中的溶质只有FeCl2和HCl,滤液加水稀释到320mL时,盐酸的浓度为0.25mol/L。
请回答:
(1)反应生成氢气的物质的量为_______ mol;
(2)计算原混合物中铁单质的质量(写出计算过程)。________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )


A. 图①中ΔH1=ΔH2+ΔH3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
C. 图③表示醋酸溶液滴定 NaOH溶液和氨水混合溶液的电导率变化曲线
D. 图④可表示由CO(g)生成CO2(g)的过程中要放出566 kJ 热量
查看答案和解析>>
科目: 来源: 题型:
【题目】I.碳元素的单质有多种形式,如图依次是C60、石墨和金刚石的结构图:
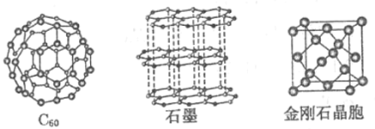
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____________、____________。
(3)C、N、O三种元素的第一电离能由小到大的顺序是______________。
(4)C60属于_____________晶体,石墨属于_____________晶体。
(5)金刚石晶胞含有_____________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_____________a。
II.FeO晶体结构如下图所示,FeO晶体中Fe2+距离最近且相等的Fe2+有________个。若该晶胞边长为b cm,则该晶体的密度为_________g·cm-3。(用NA表示阿伏伽德罗常数)

查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.2mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000mo1· L—1NaOH溶液滴定25.00mLCH3COOH的滴定曲线,则c(CH3COOH)=0.100 mo1· L—1
C. 图3表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
D. 图4表示恒温恒容条件下,2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lgc(OH-)]。下列说法正确的是

A.曲线N表示![]() 与pOH的变化关系
与pOH的变化关系
B.常温下,Ka2(H2XO3)=10-10
C.当pOH=2时, NaHXO3溶液中:![]()
D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO3-)+2c(XO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是铜与浓硫酸反应的实验装置图:

(1)仪器①的名称是_____________;
(2)实验过程中,试管③中发生的现象为____________________________________;
(3)试管②中铜与浓硫酸反应的化学方程式为 _______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 测定等浓度的Na2CO3和Na2SO3溶液的pH,Na2CO3的pH大于Na2SO3溶液 | S的非金属性比C强 |
B | 常温下,用pH试纸测得:0.1mol·L-1NaHSO3溶液的pH约为5 |
|
C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
D | 向2mL0.1mol·L-1NaOH溶液中滴加3滴0.1mol·L-1MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol·L-1FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com