
科目: 来源: 题型:
【题目】完成下列各题。
(1)在25℃101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为___。
(2)同素异形体在一定条件下可以相互转化。已知:
白磷燃烧:P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
红磷燃烧:P(s)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H=-738.5kJ/mol
P4O10(s) △H=-738.5kJ/mol
则相同状况下,能量状态较低的是___;白磷的稳定性比红磷___(填“高”或“低”),写出白磷转化为红磷的热化学方程式为___。
(3)已知CH4的燃烧热为akJ/mol,断裂1molO=O键时吸收热量bkJ,形成1molH—O键时放出热量ckJ,形成1molC=O键时放出热量dkJ,则C—H键断裂时吸收热量为___(用abcd表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H· (氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH (羟基自由基)。下列说法错误的是( )。
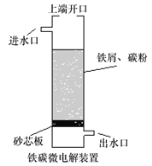
A.无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B.不鼓入空气时,正极的电极反应式为H++e-= H·
C.鼓入空气时,每生成1mol·OH有2mol电子发生转移
D.处理含有草酸(H2C2O4)的污水时,上端开口不需要应打开
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
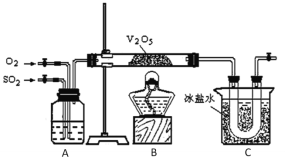
(1)已知450℃时,反应2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)
2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)![]() 2SO2(g)+O2(g)的化学平衡常数为___。
2SO2(g)+O2(g)的化学平衡常数为___。
(2)A中的试剂是___。
(3)在实验过程中不必持续加热,说明该平衡的△H___0(填“>”或“=”或“<”),C装置用来收集三氧化硫,其中冰盐水的作用是___;若用32g铜跟足量浓硫酸反应制取二氧化硫,实验结束时得到20g三氧化硫,该实验中二氧化硫的转化率不小于___。
(4)请指出本套实验装置的明显缺陷是:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气溶于水形成的饱和溶液中,存在以下的溶解平衡和电离平衡:NH3+H2O![]() NH3H2O,NH3H2O
NH3H2O,NH3H2O![]() NH4++OH-,这些平衡都满足勒夏特列原理,若向已达到平衡的体系中通入下列物质,请填空。
NH4++OH-,这些平衡都满足勒夏特列原理,若向已达到平衡的体系中通入下列物质,请填空。
(1)加入少量氨气,平衡向___(填“正”或“逆”,下同)反应方向移动。
(2)通入HCl气体,平衡向___反应方向移动,c(NH4+)___(填“增大”或“减小”,下同)。
(3)加入NaOH固体,平衡向___反应方向移动,c(OH-)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求完成下列各小题。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是___(填“锌”或“铜”),发生___反应(填“氧化”或“还原”)。

②假设反应后溶液体积不变,反应后溶液的pH为___(用对数表示)。
(2)如图是某燃料电池的示意图,请回答:
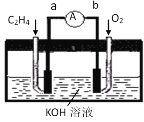
①在导线中电子流动方向为___(用a、b表示)。
②该燃料电池的负极反应式为___。
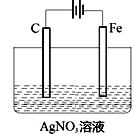
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做___极,C电极的反应式为___。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成___(包括成分和体积)。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T0时,在容积固定的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
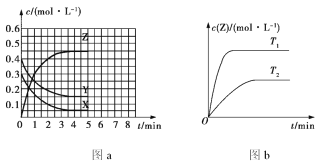
A. 发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B. 图a中反应达到平衡时,Y的转化率为37.5%
C. T0时,该反应的平衡常数为33.3
D. 该反应正反应的反应热ΔH<0
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液是中学化学中的非常重要的知识点,请根据要求填空。
(1)向NaHSO3溶液滴加石蕊溶液后变红,则HSO3-的电离程度___其水解程度(填“>”或“=”或“<”)。该物质能___(填“促进”或“抑制”)水的电离。
(2)酸碱中和滴定时,不宜用___(填“酚酞”“石蕊”或“甲基橙” )用作指示剂。用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是___(填字母)。
A.未用标准液润洗碱式滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
(3)醋酸(CH3COOH)是一种弱电解质,25℃时,醋酸的电离平衡常数表达式Ka=___。
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___。若物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),则混合后溶液呈___。
(4)现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
①若它们物质的量浓度相等,它们的pH由大到小的关系为___(用abc表示,下同)。
②若它们的pH相等,它们物质的量浓度由大到小的关系为___。
③若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3
(1)△H3=__________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应Ⅰ。下列描述能说明反应Ⅰ达到平衡状态的是_____________(填序号).
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应Ⅱ在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:

此时,v正_________v逆 (填“>”、“<”或“=”),当反应达到平衡时,混合气体中CH3OH体积分数(CH3OH)%=_________%。
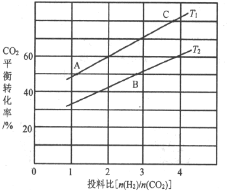
(4)反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=________;平衡常数K=_____(保留小数点后一位);KA、KB、KC三者之间的由大到小关系为______。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=![]() ×100%
×100%
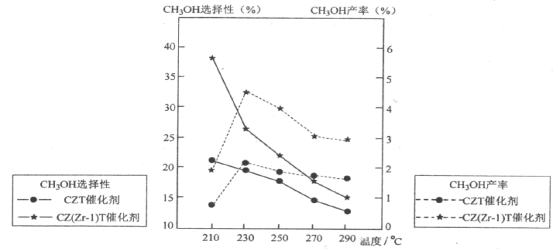
①温度高于230°C,CH3OH产率随温度升高而下降的原因是_______________。(答一条即可)
②在上述条件下合成甲醇的工业条件是___________________。
A.210°C B.230°C C.催化剂CZT D.催化剂CZ(Zr-1)T
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁的主要反应为:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
下列说法正确的是( )
A.增加Fe2O3固体可以提高CO的转化率
B.减小容器体积既能提高反应速率又能提高平衡转化率
C.该反应的正反应ΔH<0
D.当容器内气体密度恒定时,不标志该反应已达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关离子方程式书写或离子共存说法正确的是( )
A.在0.1molL-1 Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,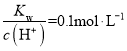 的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s) + CO32-(aq)![]() CaCO3(s) + SO42-(aq)
CaCO3(s) + SO42-(aq)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2+ + Al3+ + SO42- + OH- = BaSO4↓+ Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com