
科目: 来源: 题型:
【题目】已知一定温度下,X(g)+2Y(g) ![]() mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
A. a=b B. 2a<c C. m<3 D. m>3
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中进行反应:X2(g)+Y2(g)![]() 2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
A、Z的浓度可能为0.3mol/L
B、平衡时X2、Y2的转化率相等
C.平衡时,Y2和Z的生成速率之比为2:1
D、若平衡后再改变外界条件,升高温度,则反应的平衡常数将变大
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中充入4 mol A,在一定温度和体积可变的密闭容器中发生如下反应:4A(g) ![]() 3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
A. 若向密闭体系内再加入3molB、2molC,达平衡时C的百分含量与原平衡相同
B. 达到平衡时气体的总物质的量、密度都不发生变化
C. 反应达平衡的过程中,释放出的热量不发生变化
D. 升高温度A的转化率大于30%
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化钛是制取航天航空工业钛合金的重要原料.用钛铁矿![]() 主要成分是钛酸亚铁
主要成分是钛酸亚铁![]() ,含少量
,含少量![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 作原料生产金属钛和绿矾
作原料生产金属钛和绿矾![]() 等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以
等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以![]() 无色
无色![]() 、
、![]() 紫色
紫色![]() 形式存在.
形式存在.
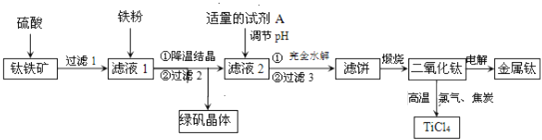
请回答下列问题:
![]() 硫酸与
硫酸与![]() 反应生成
反应生成![]() 的化学方程式是______.
的化学方程式是______.
![]() 滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
已知:氧化性:![]() 则加入铁粉的作用是______.
则加入铁粉的作用是______.
![]() 滤液2中加入适量的试剂A,可选用______
滤液2中加入适量的试剂A,可选用______![]() 填编号
填编号![]() .
.
![]() 稀
稀![]() 通入
通入![]() 鼓入空气
鼓入空气
![]() 已知
已知![]() ,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
![]() ,
,
![]() ,
,
![]()
反应![]() ______.
______.
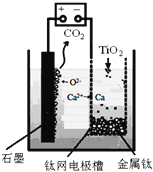
![]() 用石墨作阳极、钛网作阴极、熔融
用石墨作阳极、钛网作阴极、熔融![]() 作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
![]() 假如
假如![]() 中的铁元素占矿物中铁元素总量的
中的铁元素占矿物中铁元素总量的![]() ;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为
;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为![]() ,Ti元素的转化率为
,Ti元素的转化率为![]() ,其他损失忽略不计.按上述流程,得到
,其他损失忽略不计.按上述流程,得到![]() ______
______![]() 用数字和字母表示
用数字和字母表示![]() 已知:
已知:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】钒的化合物常用于制催化剂和新型电池。回答下列问题:
(1) V2O5为黄褐色固体,无味、有毒,微溶于水,是许多反应的催化剂。25℃时,部分含钒微粒的存在形式、浓度及存在的pH范围之间的变化关系如图所示(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未确定。
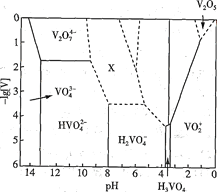
①V2O5溶于足量1.0 mol·L-1NaOH溶液中,发生反应的离子方程式为_____________________
②上述滴加H2SO4溶液的过程中,先后发生如下反应:

则“X所示区域的离子”不可能是____________(填标号)。
A.V3O93- B.V4 O103- C.V4 O124-
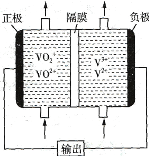
(2)如图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_________ (填“增大”“减小”或“不变”),电池充电时,阳极的电极反应式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物在我们的生产生活当中有着重要的作用,探究有机物结构有助于对物质的性质进行研究。
(1)a.![]() b.
b.![]() c.
c.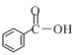
①上述三种物质中b,c中官能团名称分别是__________,__________。
②三种物质在一定条件分别与氢气发生加成反应,同温同压下消耗氢气量关系为______(填“相同”或“不相同”)。
(2)欲区分乙醛和乙酸,应选用 ____(填字母)。
a.NaOH溶液 b.HCl溶液 c.银氨溶液 d.新制氢氧化铜悬浊液
(3)工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)______。
A. 溴苯(溴):加NaOH溶液,分液 B. 乙烷(乙烯):通入溴水,洗气
C. 乙酸(水):加新制生石灰,蒸馏 D. 乙酸乙酯(乙酸):氢氧化钠溶液,分液
(4)苹果酸(![]() )与NaOH溶液反应的化学方程式___________。
)与NaOH溶液反应的化学方程式___________。
(5)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。电池放电时电解质溶液中OH-向_______(填“正”或“负”)极移动,负极反应式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.6molD,并测得C的浓度为0.15mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.6molD,并测得C的浓度为0.15mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.225mol/(Ls)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式K=c(C)c2(D)/c3(A)c(B)
D. 若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣4molL﹣1 | K1=4.4×10﹣6molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COOH、H2CO3、HClO溶液的pH最大的是_____.
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同).
A.c(H+)
B.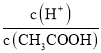
C.c(H+)c(OH﹣)
D.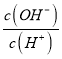
E.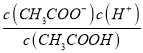
若该溶液升高温度,上述5种表达式的数据增大的是_________.
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中有水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H+),理由是___________.
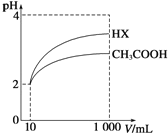
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com