
科目: 来源: 题型:
【题目】化学与我们日常生活中的吃、穿、住、行、医关系密切:
(1)油脂、淀粉、蛋白质是我们食物中提供能量的主要物质,在人体内都能发生水解。
①油脂在酸性条件下水解的最终产物是_________和_________;
②上述三种物质不属高分子化合物的是_________,若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量水解实验的溶液加入_________(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量水解溶液加入几滴________,应观察到出现蓝色;
③蛋白质在人体内水解的最终产物是氨基酸.写出氨基酸共同含有的官能团的结构简式分别为_________和﹣COOH;
(2)现在越来越多的自行车采用铝合金作材料,它不仅轻便美观,而且也很耐久.它能长期使用的原因是_________,橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施使其分子转变为_________分子结构可增大强度和弹性;
(3)聚丙烯腈﹣合成腈纶又称人造羊毛,丙烯腈为CH2=CHCN,请写出聚丙烯腈的结构简式_________,生活中除常用的氯系消毒剂外,过氧乙酸是另一种常见消毒剂,主要是因为其结构中含有_________而表现出强氧化性;
(4)_________形成的合金被称为“亲生物金属”,广泛作为人造骨的材料.为防止工业生产过程产生的悬浮颗粒物进入大气,可以将混有悬浮颗粒物的气体通过沉降进行处理;
(5)居室装修所用的有些石材会释放出一种放射性物质,长期接触可能引起癌症,免疫功能异常,该放射性物质主要是_________(填写该物质的名称);
(6)氢氧化铝、碳酸镁都可用于治疗胃酸过多引起的不适,请分别写出相关反应的离子方程式:①_________②_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3 个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图:_____。
(2)下列说法正确的是_____。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
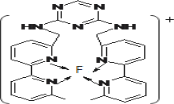
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成如图所示的离子,该离子中碳原子的杂化方式是______。
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为______。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是______。
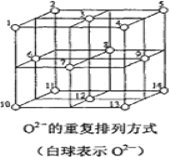
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_____,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=______pm。(写出计算表达式)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可利用CO2来制备清洁液体颜料甲醇,有关化学反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=﹣49.6kJmol-1
反应Ⅱ:CO2(g)+H2(g)H2O(g)+CO(g) △H2=+41kJmol-1
(1)反应Ⅰ在___(填“低温”或“高温”)下可自发反应。
(2)有利于提高上述反应甲醇平衡产率的条件是___。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①下列说法正确的是___。
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为___。
③分析图2中CO选择性下降的原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向20.00mL0.100molL-1的氨水和醋酸铵溶液中分别滴加0.100molL-1的盐酸溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法不正确的是( )
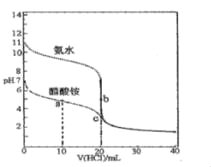
A.25℃时,Kb(NH3H2O)=Ka(CH3COOH)≈10-5
B.b点溶液中水的电离程度比c点溶液中的大
C.在c点的溶液中:c(Cl﹣)>c(CH3COOH)>c(NH4+)>c(OH﹣)
D.在a点的溶液中:c(NH4+)+2c(H+)═2c(CH3COO-)+c(NH3H2O)+2c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷与氯气光照条件下取代反应的部分反应历程和能量变化如下:
第一步:![]()
第二步:![]()
第三步:![]() 中
中![]() 其中
其中![]() 表示氯原子,
表示氯原子,![]() 表示甲基
表示甲基![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.由题可知,甲烷和氯气在室温暗处较难反应
B.![]()
C.形成![]() 中
中![]() 键放出的能量比拆开
键放出的能量比拆开![]() 中化学键吸收的能量多
中化学键吸收的能量多
D.若是甲烷与![]() 发生取代反应,则第二步反应
发生取代反应,则第二步反应![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.pH=1的硫酸溶液1L,溶液中含SO42-的数目等于0.1NA
B.真空密闭容器中充入0.1molH2和0.1molI2充分反应后,容器内分子总数为0.2NA
C.10mL0.1molL-1的FeCl3与20mL0.1molL-1KI溶液反应,转移电子数为0.001NA
D.60gSiO2晶体中Si-O键数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com