
科目: 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)(正反应为放热反应),下图是某一时间段反应速率与反应进程的关系曲线图。
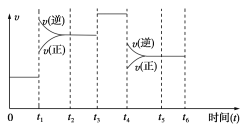
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1________,t3________,t4________。
(2)下列时间段中,氨的百分含量最高的是( )
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对实验操作及结论的描述不正确的是( )
A.![]() 如图夹紧弹簧夹,由漏斗中加水至产生液面差,一段时间后液面差不变,说明气密性良好
如图夹紧弹簧夹,由漏斗中加水至产生液面差,一段时间后液面差不变,说明气密性良好
B.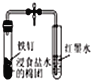 如图打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
如图打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
C.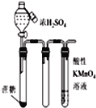 如图滴入浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化碳
如图滴入浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化碳
D.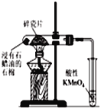 如图加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了不饱和烃
如图加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了不饱和烃
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X是合成治疗癌症药物的中间体,其合成部分路径如下:
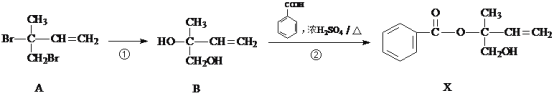
(1)反应①的反应物以及条件为________。
(2)由B制备X的过程中,有副产物C生成(与X互为同分异构体),C的结构简式为_____。
(3)下列有关X的说法正确的是________。
A.该物质属于芳香烃 B.X分子中含有一个手性碳原子
C.X可发生还原反应 D.用酸性高锰酸钾溶液可鉴别化合物X与B
(4)写出苯甲酸的一种含有苯环的同分异构体的结构简式_________。
(5)B在一定条件下发生加聚反应可得到一种高吸水性树脂,其结构简式为_________。
(6)写出X与NaOH溶液反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组学生用如下图所示装置制取丙烯酸甲酯,步骤如下:
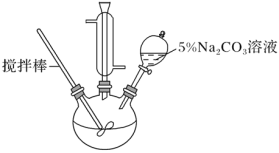
Ⅰ.取10.0 g丙烯酸(CH2=CHCOOH)和6.0 g甲醇、适量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
Ⅱ.充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗涤至中性。
Ⅲ.分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集70~90 ℃馏分。
(1) 冷凝管的作用是______
(2) 该实验中可能生成有机副产物的结构简式为____(填一种即可)。
(3) 步骤Ⅱ中混合液用5% Na2CO3溶液洗涤的目的是_______。
(4) 步骤Ⅲ中加入无水Na2SO4固体的作用是______。
(5) 已知甲醇易挥发且有毒性,请写出1条在本实验中需要采取的安全防护措施_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铝在现代生产和日常生活中应用广泛。
(1)工业上用电解熔融氧化铝的方法来制取金属铝。
①金属铝在_______(填电极名称)生成。
②电解过程中作阳极的石墨易消耗,原因是_______。
(2)英国《自然》杂志近期报道了一种新型可充铝离子电池,以金属铝和石墨为电极,用AlCl4—和有机阳离子构成电解质溶液,其放电工作原理如图所示。
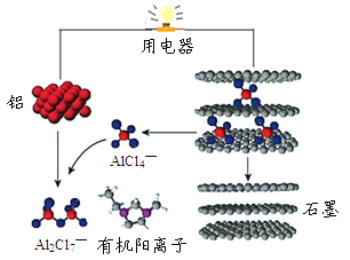
①电池放电时负极的电极反应式为_____。
②充电时有机阳离子向________电极移动(填“铝”或“石墨”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1_____0,ΔH 3_____0。(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=______kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是_______(填字母)。
A. 
B. 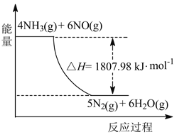
C. 
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为______kJ。
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为______。
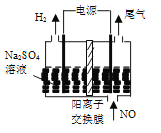
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于各装置图的叙述不正确的是
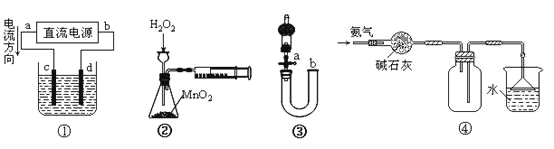
A.装置①中,c为阳极,d为阴极
B.装置②可定量测定H2O2的分解速率
C.关闭活塞a,从b处加水,可以检查装置③的气密性
D.装置④可用于收集并吸收多余的氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com