
科目: 来源: 题型:
【题目】(Ⅰ)CoCl2溶液能发生如下变化:
CoCl2![]() Co(OH)2
Co(OH)2![]() [Co(NH3)6]2+
[Co(NH3)6]2+![]() X
X![]() 晶体Y(CoCl3·5NH3)
晶体Y(CoCl3·5NH3)
向X溶液中加入强碱并加热至沸腾有氨气放出,同时产生Co2O3沉淀;若向Y的溶液中加AgNO3溶液,有AgCl沉淀生成,滤出沉淀,再向滤液中加入AgNO3溶液无变化,但加热至沸腾时又有AgCl沉淀生成,其沉淀量为上次沉淀量的一半。请回答下列问题:
(1)反应②的离子方程式是__________________________________________。
(2)反应①~③中属于氧化还原反应的是______,配合物Y的化学式为______。
(Ⅱ)一定条件下,将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),达到平衡时测得CO的物质的量为0.10mol。若平衡常数K=27,试计算(要求写出计算过程,计算结果保留两位有效数字):
CO(g)+3H2(g),达到平衡时测得CO的物质的量为0.10mol。若平衡常数K=27,试计算(要求写出计算过程,计算结果保留两位有效数字):
(1)初始加入容器的甲烷的物质的量__________;
(2)平衡时CH4的体积分数__________;
(3)若温度不变时再向上述平衡混合物中加入0.01molH2O(g)和0.1molCO,平衡是否移动__________?
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有下列五种溶液:
① | ② | ③ | ④ | ⑤ |
0.1 mol·L-1 CH3COOH溶液 | 0.01mol·L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 | 0.1 mol·L-1 NaOH溶液 | 0.1mol·L-1 氨水 |
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是_______ (填字母)。
A .中和时所需NaOH的量 B .电离程度
C .水电离出的c(H+) D. CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A. B.
B.
C. c(H+)和c(OH-)的乘积 D.OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:_______________________________________。
(5)已知CH3COOH的电离平衡常数Ka=1.8×10-5 ,另一种二元弱酸H2B的电离平衡常数为K1=4.3×10- 4 ,K2=5.6×10-1 1 试写出向Na2B溶液中加入过量CH3COOH溶液的化学方程式:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素[CO(NH2)2]作为一种中性肥料,适用于各种土壤和植物。它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种高效化肥,同时也是一种化工 原料。
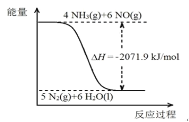
(1)以尿素为原料在一定条件下发生反应:CO(NH2)2(s) + H2O(l)![]() 2NH3(g)+CO2(g),△H = +133.6 kJ·mol-1 。在一定条件下可将氮的氧化物还原为氮气(能量示意图如下),结合相关信息写出尿素还原 NO(g)的热化学方程式是____。
2NH3(g)+CO2(g),△H = +133.6 kJ·mol-1 。在一定条件下可将氮的氧化物还原为氮气(能量示意图如下),结合相关信息写出尿素还原 NO(g)的热化学方程式是____。
(2)恒温恒容密闭容器中,下列可以证明工业合成氨气反应达到平衡的标志是_______(填序号)。
A.N2、H2 和 NH3 的浓度相等
B.1 mol 氮氮三键断裂同时 6mol N-H键断裂
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量不再改变
(3)工业上生产尿素的化学方程式:2NH3(g)+CO2(g)![]() CO( NH2)2( s)+H2O(1)。
CO( NH2)2( s)+H2O(1)。
①在一定温度和压强下,设原料气体中的氨炭比:n(NH3)/n(CO2) = x。下图是氨炭比(x)与 CO2平衡转化率[α(CO2)]的关系。α(CO2)随x的增大而增大的原因是:___________________________________。
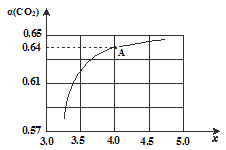
②图中A点处,NH3的平衡转化率为____________。
③在T℃,体积为10L的密闭容器中,通入6 mol NH3和3 mol CO2,反应经5 min达到平衡时n(NH3) =2mol,反应开始到平衡反应速率v(CO2)= ___________________。平衡常数 K=___________________(填计算结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容积相同,发生反应2X(g)+2Y(s)![]() 3Z(g)并达平衡。下列说法正确的是
3Z(g)并达平衡。下列说法正确的是
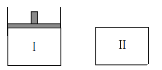
A.从起始到平衡所需时间:Ⅰ>Ⅱ
B.平衡时Z的转化率:Ⅰ<Ⅱ
C.平衡后若在Ⅰ中再加入0.1molY,则X的物质的量将减少
D.平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
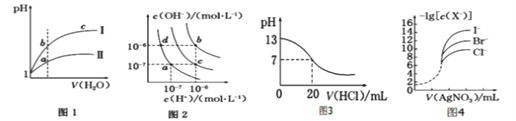
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 molL-1HCl 滴定20 mL 0.100 0 molL-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 molL-1AgNO3标准溶液滴定浓度均为0.100 0 molL-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,下列叙述不正确的是
发生电离,下列叙述不正确的是![]()
①该溶液的![]() ;
;
②升高温度,溶液的pH增大;
③此酸的电离平衡常数约为![]() ;
;
④加水稀释后,各离子的浓度均减小;
⑤由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍;
倍;
⑥适当增大HA的浓度,HA的电离平衡正向移动,电离平衡常数增大。
A.②④⑥B.①④⑤C.②⑤⑥D.②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,pH均为2的两种溶液:①醋酸溶液,②盐酸。下列说法错误的是
A.两溶液中水电离出的c(H+):①=②
B.两溶液分别加水稀释10倍,稀释后溶液的pH:②>①
C.取大小和形状完全相同的两块锌粒分别投入两种酸中,当产生相同体积的气体时所需的时间:①>②
D.等体积的两溶液分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积:①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】下列判断正确的是(NA表示阿伏加德罗常数)( )
A.常温c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO3-、Cl-四种离子
B.1 L 0.1molL-1的CH3COONa溶液中CH3COO-和OH-的总数大于0.1NA
C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ +Cu = Fe2++Cu2+
D.H2的燃烧热为a kJ·mol-1,H2燃烧热的热化学方程式为:O2(g) +2H2(g) = 2H2O(l) ΔH = -2a kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是![]()
①含有大量![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
②![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
③加入Mg能放出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
④澄清透明溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
⑤中性溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
⑥稀硫酸中:![]() 、
、![]() 、
、![]() 、
、![]()
⑦![]() 溶液中:
溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
⑧![]()
![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
⑨通入大量![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 。
。
A.②③④⑧B.②③⑤⑦C.①②③⑨D.④⑤⑥⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com