
科目: 来源: 题型:
【题目】工业上利用绿矾制备还原铁粉的工业流程如下:
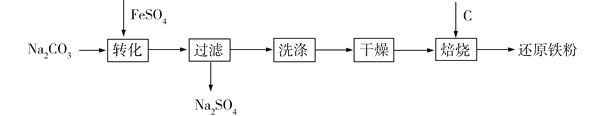
(1)制备FeCO3时,选用的加料方式是_______________(填字母)。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________。
(3)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为________________。
(4)取干燥后的FeCO3样品12.49 g隔绝空气焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为_______________(写出一种即可),计算FeCO3样品中FeCO3与FeOOH的质量_____________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___K。
II.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___。
(2)反应前A的物质的量浓度是___。
(3)10s末,生成物D的浓度为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向FeBr2溶液中通入适量Cl2,溶液由浅绿色变为黄色 | Cl2氧化性强于Br2 |
B | 常温下,等体积pH=3的HA和HB两种酸分别加水稀释,溶液导电能力如图
| HA酸性比HB弱 |
C | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X具有氧化性 |
D | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | 气体为氧气 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.氨水加水稀释后,溶液中c(NH3H2O)/c(NH4+)的值减小,c(H+)增大
B.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
C.一定温度下,增大反应2BaO2(s)![]() 2BaO(s)+O2(g)容器的体积,平衡不移动
2BaO(s)+O2(g)容器的体积,平衡不移动
D.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.合成氨生产中,使用高效催化剂可提高原料平衡转化率
B.铁质管道与锌用导线相连(如图所示)可防止管道被腐蚀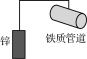
C.除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,充分反应后,加入四氯化碳,振荡后静置、分液,取上层溶液
D.合成氨生产中,将氨气液化分离,可加快正反应速率,提高H2的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是__。
(2)C的燃烧热为___。
(3)燃烧10gH2生成液态水,放出的热量为___。
(4)CO燃烧的热化学方程式为___。
(5)为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施__。
a.减压、升温 b.增压、降温 c.减压、降温 d.增压、升温
(6)写出下列反应的热化学方程式,N2(g)与适量H2(g)反应,生成2molNH3(g),放出92.2kJ热量___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
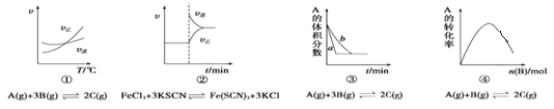
A.①是其他条件一定时,反应速率随温度变化的图像,则逆反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率变化的图象
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量混合物在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
A.m+n<pB.平衡向逆反应方向移动C.A的转化率降低D.C的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com