
科目: 来源: 题型:
【题目】已知25℃时CH3COOH的电离常数K=1.6×10-5。该温度下向20ml0.01mol/L CH3COOH溶液中逐滴加入0.01mol/LKOH溶液,其pH变化曲线如图所示(忽略温度和溶液体积的变化),下列说法正确的是( )
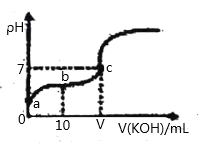
A.a点溶c(H+)为4.0×10-5mol/L
B.b点溶液中满足c(CH3COO-) +c(OH-)=c(CH3COOH)+c(H+)
C.V=20
D.滴定过程中,c(CH3COO-)+c(CH3COOH)+c(K+)=0.01mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
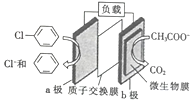
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为![]() -e-=Cl-+
-e-=Cl-+![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
A. 若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B. 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. 若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)![]() 2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
A.2s内用物质A表示的平均反应速率为0.6mol/(L·s)
B.该条件下,该反应的平衡常数为K=![]()
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.2s时物质B的浓度为0.7mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法不正确的是( )
A. 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>①
B. 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性
C. 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④
D. 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】已知取H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
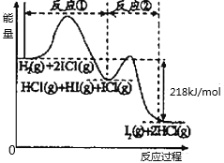
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.H2(g) +2ICl(g)=I2(g)+2HCl(g) △H=-218kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
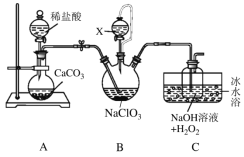
已知:①ClO2沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
②NaClO2饱和溶液低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解为NaClO3和NaCl。
③B装置为ClO2发生装置,所用试剂NaClO3、H2SO4(浓)、CH3OH。
请回答下列问题:
(1)装置B中试剂X的名称为___________;盛放该试剂的仪器的名称为________________。
(2)实验过程中需持续通入一定量的CO2,其目的是______________;反应结束后需再通入一定量的CO2,其目的是_____________________。
(3)装置C中的水浴温度应控制在____________________(填温度范围);装置C中生成NaClO2的离子方程式为___________________。
(4)上述装置存在一处明显的缺陷,其改进措施为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为元素周期表的另一种画法——塔式周期表,上面标有部分族及部分元素。请根据周期表中所列的元素回答问题:
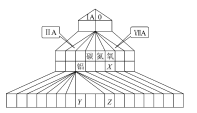
(1)碳、氮、氧三种元素的电负性由小到大的顺序为_____________________。
(2)Y3+的结构示意图为_____________,Z的价电子排布式为_______________。
(3)原子簇是由几个到几百个原子组成的相对独立的物质结构单元,如铝原子簇Al13、Al14。已知原子簇价电子总数为2,8,20,34,40,58……时,原子簇可稳定存在。
①Al13的化学性质与第__________族元素性质相似
②Al14达到稳定时,呈现的化合价为+2,其原因是___________________。
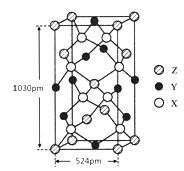
(4)某种化合物由X、Y、Z三种元素组成,其晶胞结构如图所示,则其化学式为____________,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:ρ=_______gcm-3(只要求列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) △H=—15.73kJ·mol-1
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1B.-109kJ·mol-1C.+218kJ·mol-1D.+109kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)25℃下,纯水中c(H+)=1×10-7 mol·L-1,则此时c(OH-)=______________,该温度下向纯水中加盐酸,使溶液中的c(H+)=1×10-3 mol·L-1,则此时溶液的pH=_______________。若25℃下,向纯水中加入NaOH固体,使溶液的pH=13,此时溶液中c(OH-)=___________。 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 ![]() NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
(2)同素异形体相互转化的反应热相当少而转化速率慢,有时还很不完全,测定时很 困难,现可依据盖斯定律进行计算。已知:
P4 (白磷,s) + 5O2 (g) = 2P2O5 (s); △H1 =-283.2 kJ·mol-1 ①
4P (红磷,s) + 5O2 (g) = 2P2O5 (s); △H2 =-184.0kJ·mol-1 ②
由热化学方程式看来,更稳定的磷的同素异形体是 ______(填“白磷”或“红磷”) ,试写出白磷转化成红磷的热化学方程式______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com