
科目: 来源: 题型:
【题目】如图A为浸透饱和氯化钾溶液和酚酞试液的滤纸,B为电镀槽、回答下列问题:

(1)闭合K1打开K2,滤纸A的左端显________(填“蓝色”“红色”或“无色”);滤纸A上发生的总化学方程式为________________;
(2)欲在铁片上镀锌,则X的电极材料为________,镀件为________(填“阴”或“阳”)极;电镀时应将K1、K2同时闭合,电极Y上发生的电极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用反应CCl4 +4Na![]() C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于原子晶体
B.该反应利用了Na的强还原性
C.CCl4和C(金刚石)中的C的杂化方式相同
D.NaCl晶体中每个Cl-周围有8个Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A和B反应的化学方程式为A(g)+2B(g)![]() C(g)。回答下列问题:
C(g)。回答下列问题:
(1)图1是反应A(g)+2B(g)![]() C(g)在不同温度下A的转化率随时间变化的曲线。
C(g)在不同温度下A的转化率随时间变化的曲线。
①该反应的H________(填“>”“<”或“=”)0。
②在T1温度下,向体积为1 L的密闭容器中,充入1 mol A(g)和2 mol B(g),测得A(g)和C(g)的浓度随时间变化如图2所示。则10 min内C的生成速率为________________。
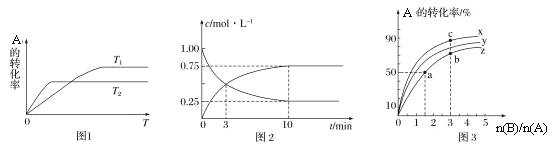
③若容器容积不变,下列措施可增加A转化率的是________(填字母)。
a.升高温度 b.将C(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容密闭容器中,分别研究在230°C、250°C和270°C条件下的上述反应。三种温度下B与A的物质的量之比与A平衡转化率的关系如图3所示。曲线z对应的温度是________°C。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。下列说法错误的是( )
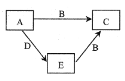
A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B. Y的最高价氧化物的水化物为弱酸
C. Y、Z组成的分子可能为非极性分子
D. W是所在周期中原子半径最小的元素
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下几种弱酸或弱碱的电离平衡常数(Ka或Kb)如下表所示:
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HCN | 5×10-10 |
NH3H2O | 1.8×10-5 |
H2SO3 | K1=1.5×10-2,K2=1.1×10-7 |
回答下列问题:
(1)CH3COONH4的水溶液呈中性,其理由是_____________,溶液中各离子浓度大小的关系是___________________。
(2)等物质的量浓度的下列五种溶液:①NH3H2O ②(NH4)2SO3 ③NaHSO3 ④Na2SO3
⑤H2SO3溶液中水的电离程度由大到小的排列顺序为________(填序号)。
(3)向25 mL 0.10 molL-1盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是________(填字母)。
A.c(Cl-)=c(NH4+)>c(H+)=c(OH-) B. c(NH4+)>c(Cl-)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(Cl-)>c(H+) D.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)在室温下,0.05 molL-1的NaCN溶液的pH约为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )

A. 分子中有3个手性碳原子
B. 分子中有3种含氧官能团
C. 该物质既可发生消去反应又可发生加成反应
D. 1mol该物质与足量NaOH溶液反应时消耗1molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是________(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能
(2)已知:
Ⅰ.H2(g)+![]() O2(g)=H2O(g) H1=-241.8kJmol-1
O2(g)=H2O(g) H1=-241.8kJmol-1
Ⅱ.H2(g)+![]() O2(g)=H2O(l) H2=-285.8kJmol-1
O2(g)=H2O(l) H2=-285.8kJmol-1
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O-H | 465 |
O=O | 498 |
①氢气的燃烧热为________kJmol-1.
②断开1 mol H-H键需要吸收的能量为________kJ。
③36 g H2O(1)完全分解生成氧气和氧气,需要吸收________kJ的能量。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
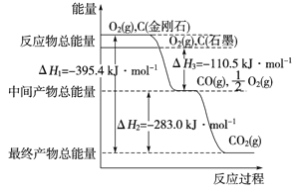
①在通常状况下,金刚石和石墨的稳定性较大的是________ (填“金刚石”或“石墨”)。
②12 g石墨在一定量空气中燃烧,生成36g气体,该过程放出的热量为________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
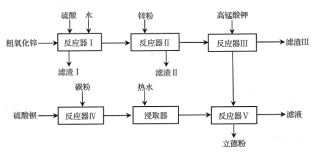
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:
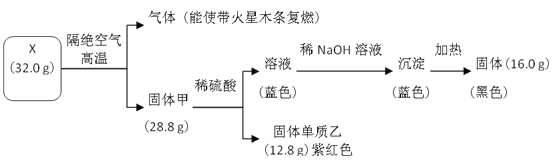
请回答:
(1)X 的化学式是______________。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________。
(3)写出固体甲与稀硫酸反应的化学方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的综合利用有如下转化关系。CO和H2按不同比例可分别合成A和B,已知烃A对氢气的相对密度是14,B能发生银镜反应,C为常见的酸味剂。

请回答:
(1)有机物D中含有的官能团的名称为______________。
(2)反应⑥的类型是______________。
(3)反应④的方程式是_______________________________________。
(4)下列说法正确的是________。
A.有机物A能使溴水和酸性高锰酸钾溶液褪色
B.有机物B和D能用新制碱性氢氧化铜悬浊液鉴别
C.有机物C、D在浓H2SO4作用下制取CH3COOCH2CH3,该反应中浓H2SO4是催化剂和氧化剂
D.有机物C没有同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com