
科目: 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,_____,搅拌。
②_____。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,_____,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数_________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ 1/2O2(g) ![]() SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A. 196.64kJB. 小于98.32kJ
C. 小于196.64kJD. 大于196.64kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
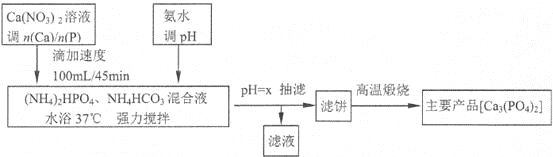
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是______________________________。流程中调pH选氨水,不选生石灰或石灰乳的理由是_____________________________。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为___,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和_____________。
(3)酸性条件下产率偏低的原因是________________________________________。
(4)“高温煅烧”滤饼,化学反应方程式为___________________________________。
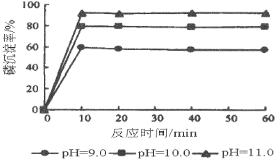
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+![]() O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
A.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=+317.3kJ·mol-1
B.Zn+Ag2O=ZnO+2Ag ΔH=+317.3kJ·mol-1
C.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=-379.3kJ·mol-1
D.2Zn(s)+2Ag2O(s)=2ZnO(s)+4Ag(s) ΔH=-634.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关能量的判断和表示方法正确的是( )
A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,可知:含1 mol/L CH3COOH的溶液与含1mol/L NaOH的溶液混合,放出热量等于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为H2(g)+![]() O2(g) =H2O(l) ΔH=-285.8 kJ/mol
O2(g) =H2O(l) ΔH=-285.8 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1(NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5mol·L-1,应保持溶液中c(C2O42-)≥_____mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为_____。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将____(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量_____(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学进行胆矾结晶水测定实验,得到下(1)~(4)组数剧:
编号 | 加热前 | 加热后 | |
坩埚质量(克) | 坩埚+胆矾质量(克) | 坩埚+无水CuSO4质量(克) | |
(1) | 5.0 | 7.5 | 6.6 |
(2) | 5.42 | 7.95 | 6.8 |
(3) | 5.5 | 8.0 | 7.1 |
(4) | 5.0 | 7.5 | 6.8 |
实验数据表明有两次实验失误,失误的实验是( )
A.(1)和(2)
B.(2)和(4)
C.(1)和(3)
D.(3)和(4)
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是( )
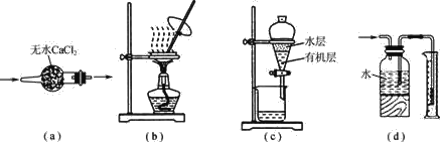
A.用图a所示装置干燥SO2气体
B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氨气的体积
查看答案和解析>>
科目: 来源: 题型:
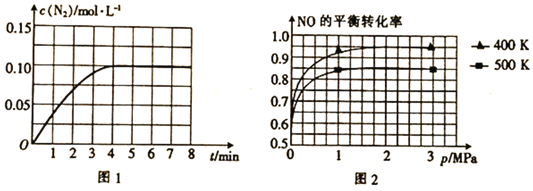
【题目】I.2017年5月5日,中国首架按照国际标准研制的拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<0。
N2(g)+2CO2(g)△H<0。
(1)若将1mol NO和2mol CO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=__________,4min末CO的浓度为__________mol·L-1。
(2)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置中比较适合的温度和压强是__________
II.取50 mL0.50mol·L-1NaOH溶液和50 mL、0.50mol/L硫酸溶液进行中和热测定实验,实验数据如下表:
(1)请填写表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 31.4 | |
(2)近似认为0.50mol·L-1 NaOH 溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c =4.18J·g-1·℃-1。则中和热△H=__________。(取小数点后一位)
(3)上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com