
科目: 来源: 题型:
【题目】A、B、C、D四种元素原子的核电荷数依次增大![]() 均小于
均小于![]() ,其单质及相应的化合物能发生如下反应关系:
,其单质及相应的化合物能发生如下反应关系:
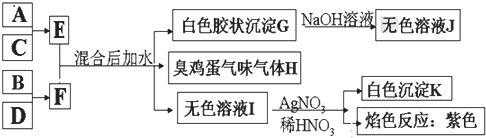
(1)写出F的电子式 ______ 。
(2)气体H有毒,可用![]() 溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
(3)加热E的水溶液后并灼烧,最终得到的固体为 ______ ,原因为 ______ 、 ______ ![]() 用化学反应方程式来表示
用化学反应方程式来表示![]() 。
。
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的![]() ,则此溶液中离子浓度由小到大的顺序为: ______ 。
,则此溶液中离子浓度由小到大的顺序为: ______ 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物![]() ,
,![]() 可与氧气继续反应:
可与氧气继续反应:![]() ,在一个固定容积为2L的密闭容器中充入
,在一个固定容积为2L的密闭容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含![]() 为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入
为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入![]()
![]() 和
和![]()
![]() ,再次达到新平衡后,
,再次达到新平衡后,![]() 的物质的量介于 ______ 之间。
的物质的量介于 ______ 之间。
(6)写出E和F反应的化学反应方程式: ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为________L(已知:1个e-所带电量为1.6×10-19C)。
Ⅱ.溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为______________。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
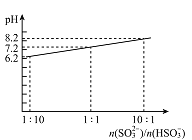
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因________________。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是_____________。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
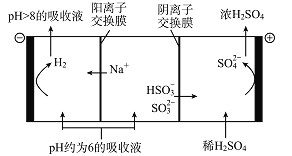
①写出阳极发生的电极反应式________________;
②当电极上有2 mol电子转移时阴极产物的质量为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备
是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备![]() 的反应:
的反应:![]() ,在体积为1L的恒容密闭容器中,充2molCO和
,在体积为1L的恒容密闭容器中,充2molCO和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
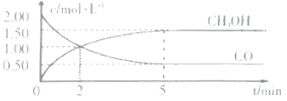
①从反应开始到5min,用一氧化碳表示的平均反应速率υ(CO)=______。
②下列说法正确的是______。
A.达到平衡时,![]() 的转化率为
的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氨气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应:
以体积比1:2置于密闭容器中发生反应:
![]() ,达到平衡时
,达到平衡时![]() 的体积分数为
的体积分数为![]() ,该反应的平衡常数
,该反应的平衡常数![]() ______。
______。
(3)碳与水蒸气反应制取![]() 的相关反应如下:
的相关反应如下:
Ⅰ![]()
Ⅱ![]()
Ⅲ![]()
①计算反应![]() 的
的![]() ______
______![]()
②对于可逆反应![]() ,采取以下措施可以提高
,采取以下措施可以提高![]() 产率的是______。
产率的是______。
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(4)以甲醇为燃料,![]() 为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]() 。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
(5)若往20mL![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
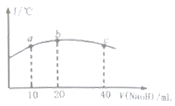
①该烧碱溶液的浓度为![]()
②该烧碱溶液的浓度为![]()
③![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】向1L浓度均为![]() 和氢氧化钠的混合溶液中缓慢加入二氧化碳,随
和氢氧化钠的混合溶液中缓慢加入二氧化碳,随![]() 增大,溶液中下列离子浓度对应关系正确的是 ( )
增大,溶液中下列离子浓度对应关系正确的是 ( )
选项 |
| 溶液中离子的物质的量浓度关系 |
A |
| c(Na+)>c(CO32-)>c(OH-)>c(AlO2-) |
B |
|
|
C |
|
|
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示的装置分别进行如下实验,各离子方程式正确及各组物质反应后,溶液的导电性比反应前增强的是( )
A.向硝酸银溶液中通入少量氯化氢:Ag++Cl-=AgCl↓
B.向亚硫酸溶液中通入氯气:H2SO3+C12+H2O=SO42-+4H++2Cl-
C.向FeBr2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
D.向NaOH溶液中通入少量氯气:2OH-+Cl2=Cl-+ClO-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
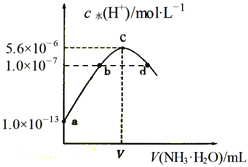
A. V=40
B. c点所示溶液中:c(H+ )-c(OH-)=2c(NH3·H2O)
C. NH3·H2O的电离常数K=10-4
D. d点所示溶液中:c(NH4+)=2c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 时,向
时,向![]() 中不断滴入
中不断滴入![]() ,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是
,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是![]() 已知:
已知:![]() 时一元酸
时一元酸![]() 电离平衡常数
电离平衡常数![]()
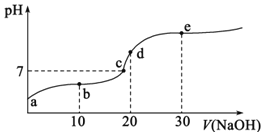
A.a点溶液的pH大于3
B.b点溶液中离子:![]()
C.c点表示酸![]() 和
和![]() 溶液恰好完全反应
溶液恰好完全反应
D.d点溶液加水稀释后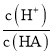 的值会增大
的值会增大
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.相同条件下,测得![]() 溶液的pH大于相同物质的量浓度的
溶液的pH大于相同物质的量浓度的![]() 溶液,说明非金属性:
溶液,说明非金属性:![]()
B.绝热容器中,向50mL1![]() 的盐酸中加入烧碱,水的
的盐酸中加入烧碱,水的![]() 不变
不变
C.相同温度时,![]() 分别在相同物质的量浓度的
分别在相同物质的量浓度的![]() 溶液和
溶液和![]() 溶液中的溶解度相同
溶液中的溶解度相同
D.有HX和HY两种弱酸且酸性![]() ,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有
,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5,该温度下,用0.100mol·L-1的氨水滴定10.00mL0.100mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如右图所示。下列说法不正确的是
的关系如右图所示。下列说法不正确的是
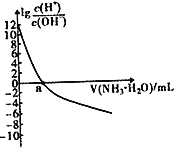
A. a=10 B. HA为强酸
C. 25℃时,NH4+的水解平衡常数为![]() ×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com