
科目: 来源: 题型:
【题目】油酸甘油酯和硬脂酸甘油酯均是天然油脂的成分。 它们的结构简式如下图所示。
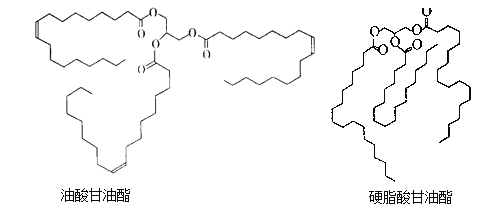
下列说法错误的是
A. 油酸的分子式为C18H34O2
B. 硬脂酸甘油酯的一氯代物共有54种
C. 天然油脂都能在NaOH溶液中发生取代反应
D. 将油酸甘油酯氢化为硬脂酸甘油酯可延长保存时间
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,![]() 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
B.裂化汽油是一种良好的有机溶剂,可以用于清洗衣物油渍和萃取溴水中的卤素
C.DDT的结构简式为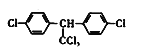 ,分子中最多有13个碳原子共平面
,分子中最多有13个碳原子共平面
D.![]() 的单体是CH3-C≡C-CH3和CH2=CH-CN
的单体是CH3-C≡C-CH3和CH2=CH-CN
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是_______。
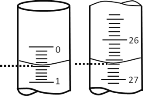
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则滴定结束时的读数为___________ mL,所用硫酸溶液的体积为_______mL。
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1硫酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为___mol·L-1(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____(填字母)。
A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸
B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.锥形瓶用水洗涤后,用待测液润洗
(5)酸碱中和滴定原理也可用于其它类型的滴定。如:一种测定水样中Br-的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1 mol/L AgNO3溶液(过量),充分摇匀。
③用c2mol/L KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL。
计算该水样中Br-的物质的量浓度为_______mol·L-1(已知:Ksp(AgBr)= 7.7×10-13,Ag++ SCN-=AgSCN(白色)↓ ,Ksp(AgSCN)= 1×10-12)。
Ⅱ、某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。实验装置如图所示。
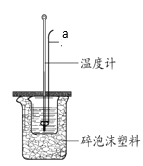
(6)仪器a的名称是_______。
(7)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,和后生成溶液的比热容c=4.18 J/(g·℃)。则计算得中和热ΔH=______(取小数点后一位)。
(8)上述实验结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】对反应3SO2(g) + 2H2O(g)![]() 2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
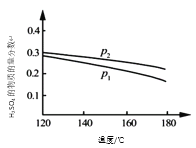
(1)p2___ p1(填“>”或“<”),得出该结论的理由是____。
(2)为了提高SO2的平衡转化率,可采取适当增大压强、_____、______(任意补充两个合理措施)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验原理、现象、结论等均正确的是
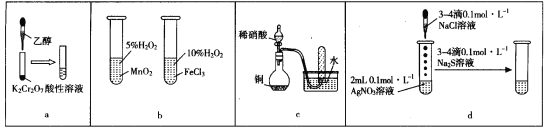
A.a图示装置,滴加乙醇试管中橙色溶液变为绿色,乙醇发生消去反应生成乙酸
B.b图示装置,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好
C.c图示装置,根据试管中收集到无色气体,验证铜与稀硝酸的反应产物是NO
D.d图示装置,试管中先有白色沉淀、后有黑色沉淀,不能验证AgCl的溶解度大于Ag2S
查看答案和解析>>
科目: 来源: 题型:
【题目】环境问题是现在全世界的重要课题。
(1)NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应:2CO +2NO=N2+2CO2,为了控制大气污染,提出以下建议,你认为可行的是_______(填编号)。
A.使用催化剂 B.改变压强 C.提高反应温度
(2)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是
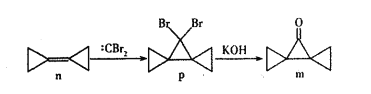
A. n分子中所有原子都在同一个平面上
B. n和:CBr2生成p的反应属于加成反应
C. p分子中极性键和非极性键数目之比为2:9
D. m分子同分异构体中属于芳香族化合物的共有四种
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.标况下,11.2L甲醇中含有的电子数9NA
B.6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
C.100mL0.1mol/L的KAl(SO4)2溶液中含有的阳离子总数小于0.02NA
D.分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
查看答案和解析>>
科目: 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
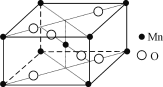
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别加水稀释,其pH随加水体积的变化如图所示。

(1)曲线Ⅰ代表____溶液(填“HNO2”或“CH3COOH”,下同)。
(2)a点时,物质的量浓度较大的是______溶液。相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)较少的是_____。
(3)b、c两点溶液中水的电离程度较大的是___ (填“b”或“c”)。
(4)CH3COOH的稀释过程中,下列说法正确的是___ (填编号)。
a.CH3COOH的电离常数增大
b.H+的物质的量减小
c. ![]() 保持不变
保持不变
d. CH3COOH的电离程度增大,溶液的导电能力增强
Ⅱ、25℃,两种酸的电离平衡常数如表。
|
| |
H2A | 4.4×10-7 | 4.7×10-11 |
H2B | 1.3×10-7 | 7.1×10-15 |
(5)HA-的电离平衡常数表达式K =_______。
(6)0.10 molL-1 NaHB溶液中H+、OH-、Na+、HB-的浓度由大到小的顺序为_______。
(7)等浓度的四种溶液:a. Na2A、b. NaHA、c. Na2B、d. NaHB的pH由大到小顺序是_______(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com