
科目: 来源: 题型:
【题目】下列事实与所对应的离子方程式正确的是
A. 室温下,测定醋酸钠溶液的pH > 7:CH3COONa === CH3COO-+Na+
B. 实验室用氯化铝溶液和氨水制备氢氧化铝:Al3+ +3OH- === Al(OH)3↓
C. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3 + 2H+ === SO2 ↑ + S↓+ 2Na+ + H2O
D. 用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s) + CO32-(aq) === CaCO3(s) + SO42-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,Kw不变
D.向纯水中加入醋酸钠固体或盐酸,均可抑制水的电离,Kw不变
查看答案和解析>>
科目: 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示。

(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:
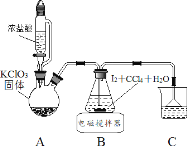
HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+ IO3- =IO4 -+ Cl- |
回答下列问题:
步骤Ⅰ用 Cl2 氧化 I2 制取 HIO3
(1)装置 A 中发生反应的化学方程式_______。
(2)装置 B 中的 CCl4 可以加快反应速率,原因_______。
(3)反应结束后,获取 HIO3 溶液的操作中,所需玻璃仪器有烧杯、________和_______。
步骤Ⅱ用 KOH 中和 HIO3 制取 KIO3
(4)该中和反应的离子方程式为_______。中和之前,应将上述 HIO3溶液煮沸至接近无色,否则中和时易生成_______(填化学式)而降低 KIO3 的产量。
(5)往中和后的溶液中加入适量_______,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量 SO2 饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的 SO2 饱和溶液过量,则无蓝色出现,原因是_______。
步骤Ⅲ纯度测定
(7)取 0.1000 g 产品于碘量瓶中,加入稀盐酸和足量 KI 溶液,用 0.1000 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗 Na2S2O3 溶液的体积为 24.00 mL。则产品中 KIO3 的质量分数为_______。[M(KIO3)=214.0 g·mol-1]
查看答案和解析>>
科目: 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:
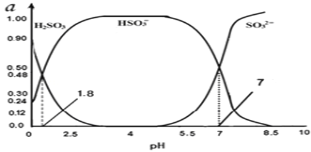
①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[C(H+)/c(OH-)]的关系如图所示。下列说法正确的是

A. MOH的电离方程式为MOH![]() M++OH-
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃,时,CH3COO-的水解平衡常数为(10/17)×10-9
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下图装置中的叙述正确的是( )

A.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色
C.这是电解NaOH溶液的装置
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】丁香酚存在于丁香花的花蕊中,以丁香酚为原料制取有机物 F 的路线如下:
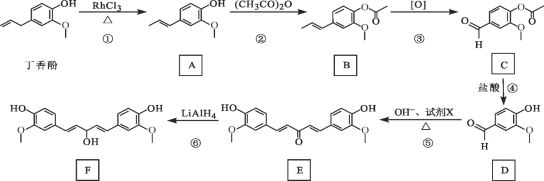
已知:![]()
(1)丁香酚的分子式为_______。
( 2) A 中的含氧官能团是_______( 填名称), ② 的反应类型为_______。
(3)写出满足下列条件的 C 的所有同分异构体的结构简式_______。
①含苯环且环上只有两个取代基;
②属于酯类化合物;
③核磁共振氢谱有 3 组峰,且峰面积之比为 3∶1∶1。
(4)1 mol D 最多可以与_______molH2 发生加成反应。
(5)反应⑤中,试剂 X 的结构简式为_______。
(6)设计用呋喃甲醛( ![]() )和环己醇为原料制
)和环己醇为原料制 ![]() 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L1 KBrO3标准溶液;
Ⅱ.取v1 mL上述溶液,加入过量KBr,加HSO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b mol·L1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v2 mL。
已知:I2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和____________。
(2)Ⅰ中发生反应的离子方程式是_______________________________。
(3)Ⅲ中发生反应的化学方程式是_________________________________。
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是______________________________。
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是________。
(6)Ⅴ中滴定至终点的现象是_____________________________。
(7)废水中苯酚的含量为___________g·L1(苯酚摩尔质量:94 g·mol 1)。
(8)由于Br2具有____________性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com