
科目: 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】【选修3:物质结构与性质】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________。
②在[Cu(NH3)4]SO4中,Cu2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_________。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_________。但NF3不易与Cu2+形成化学键,其原因是_______________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为__________。
②已知该晶胞中两个Ba2+的间距为cpm.则距离Ba2+最近的Hg+数目为_____个,二者的最短距离为_______pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
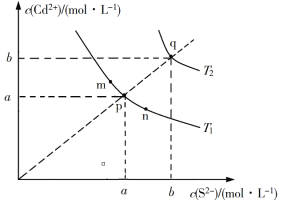
A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
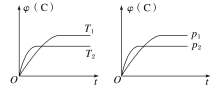
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.该反应的ΔH<0
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】欲使NH4Cl稀溶液中c(NH4+)/c(Cl-)比值增大,可在溶液中(恒温并忽略溶液体积的变化)加入少量下列物质中的( )
①通入HCl;②H2SO4;③NH4Cl固体;④NH4NO3固体 ⑤Ba(OH)2固体
A.②或③或④B.①或②或④C.②或③或⑤D.①或③或⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
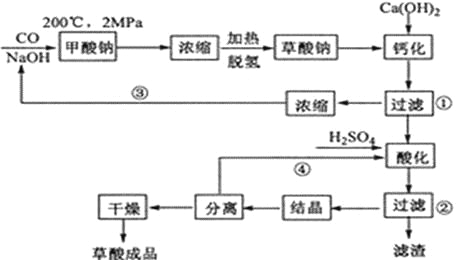
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为______________________________、_______________________________________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是_______,滤渣是_______;过滤操作②的滤液是__________和___________,滤渣是______________。
(3)工艺过程中③和④的目的是____________________________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是_____________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为__________________________;列式计算该成品的纯度________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在体积为VL的密闭容器中加入1 molX和1 molY进行如下反应: X(g)+Y(g)![]() 2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入催化剂,上述反应的△H增大
C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的![]()
D.升高温度,平衡逆向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )
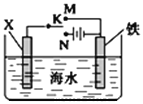
A.若X为碳棒,开关K置于N处,为外加电源的阴极保护法,可减缓铁的腐蚀
B.若X为碳棒,开关K置于N处,X极发生氧化反应
C.若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法,可减缓铁的腐蚀
D.若X为锌棒,开关K置于M处,铁极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com