
科目: 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是()
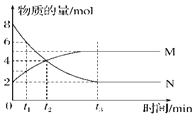
A.反应的化学方程式为:![]()
B.![]() 时,正逆反应速率相等
时,正逆反应速率相等
C.![]() 时,当反应达最大限度时,化学反应随即停止
时,当反应达最大限度时,化学反应随即停止
D.![]() 时,反应达到平衡时,压强是开始时的
时,反应达到平衡时,压强是开始时的![]() 倍
倍
查看答案和解析>>
科目: 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固体 ③滴入几滴浓盐酸
固体 ③滴入几滴浓盐酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加几滴硫酸铜溶液
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用![]() 的盐酸
的盐酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液有许多奇妙之处,你只有深入的去思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )
A.浓度相同的![]() 、
、![]() 两种盐溶液中,所有阴离子总浓度后者大
两种盐溶液中,所有阴离子总浓度后者大
B.常温下,1![]() 的
的![]() 溶液与1
溶液与1![]() 的NaOH溶液混合后,所得混合液中:
的NaOH溶液混合后,所得混合液中:![]()
C.物质的量浓度相同的![]() 和
和![]() 两种溶液中,
两种溶液中,![]() 前者小于后者
前者小于后者
D.常温下,某溶液中由水电离出的![]() ,则此溶液可能是盐酸
,则此溶液可能是盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A.用金属活动性顺序可解释反应:Na(l)+KC1(l)=NaCl(l)+K(g)
B.0.1mol Na2O2和足量CO2气体充分反应,理论上转移的电子数目为0.2×6.02×l023
C.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
D.常温下,NH4C1溶液加水稀释后,溶液中的Kw值不变
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200mL饱和CuSO4溶液,a、b、c、d均为石墨电板,通电一段时间后,B池中阴极增重0.64g。
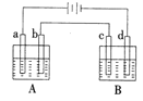
(1)A池中阳极的电极反应式为________。
(2)计算通电过程中A、B两池阳极分别产生气体的体积(标准状况下)__________、_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可氢气反应生成烷,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
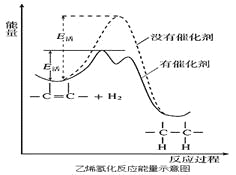
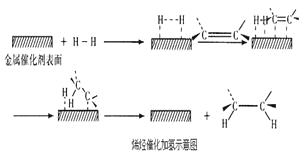
下列说法中正确的是
A. 乙烯和H2生成乙烷的反应是吸热反应
B. 加入催化剂,可减小反应的热效应
C. 催化剂能改变平衡转化率,不能改变化学平衡常数
D. 催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的NaOH溶液,两者pH都升高了1。则加入水和加入NaOH溶液的体积比约为( )
A. 11∶1 B. 10∶1 C. 6∶1 D. 5∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应是工业生产硝酸的一个反应过程,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-1025 kJ/mol,若反应物起始的物质的量相同。下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g) ΔH=-1025 kJ/mol,若反应物起始的物质的量相同。下列关于该反应的示意图不正确的是
A.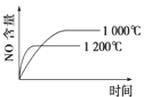 B.
B.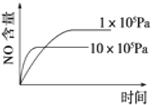
C.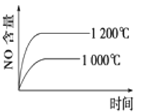 D.
D.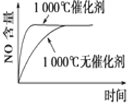
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.1mol Cl2参加的任何反应,反应过程中转移电子数都是2NA
B.17g氨气所含的电子数为NA
C.46gNO2和N2O4混合气体中含有原子个数为3NA
D.标准状况下,11.2L乙醇所含分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】应用酸碱中和滴定原理测定某市售白醋的含量。
I.实验步骤
(I)量取10.00mL食用白醋,稀释到100mL,得到待测白醋溶液,取待测白醋溶液20.00mL于锥形瓶中,向其中滴加几滴________作指示剂。
(2)碱式滴定管盛装0.1000mol/LNaOH溶液初始时的液面位置如图所示,此时的读数_____mL。
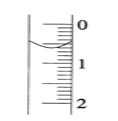
(3)滴定过程中,滴至_________________时即为滴定终点,记录NaOH溶液的最终读数。重复滴定4次。
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol/LNaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | l5.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(4)按实验所得数据,可折算得c(市售白醋)=__________mol/L。
(5)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填选项字母)。
a.碱式滴定管在装液前未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气池,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com