
科目: 来源: 题型:
【题目】某化学兴趣小组设计如下实验方案,将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
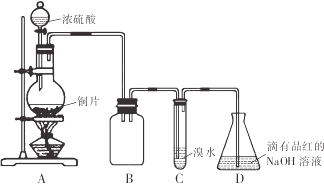
请回答下列问题:
(1)装置B的作用是______。
(2)设计装置C的目的是验证SO2的______性,装置C中发生反应的离子方程式是______装置D中NaOH全部转化为NaHSO3的标志是______。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
序号 | 实验操作 | 现象 | 结论 |
① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | _______ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液、振荡 | 溶液为紫色 | ____ |
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题。

(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的___________棒,乙池中的________棒。
②乙池中阳极的电极反应式是:_________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:____________________。
②甲池中碳极的电极反应式是:______________,乙池中碳极的电极反应属于_______(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池中碳极附近,发现试纸变蓝,过一段时间后又发现蓝色褪去,这是因为过量的Cl2又将生成的I2氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封放置一段时间后,下列有关说法正确的是 ()
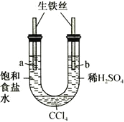
A.a管发生析氢腐蚀,b管发生吸氧腐蚀
B.一段时间后,b管液面高于a管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为_________。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为_____L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是______:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)___V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
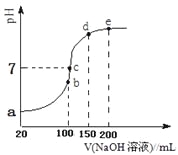
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序___________。
③d、e点对应溶液中,水电离程度大小关系是d______e(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】富铁铝土矿![]() 主要含有
主要含有![]() 、
、![]() 、FeO和
、FeO和![]() 可制备新型净水剂液体聚合硫酸铝铁
可制备新型净水剂液体聚合硫酸铝铁![]() 研究发现,当
研究发现,当![]() 时净水效果最好.工艺流程如下
时净水效果最好.工艺流程如下![]() 部分操作和产物略
部分操作和产物略![]() :
:
![]()
![]() 与
与![]() 发生反应的离子方程式是 ______ .
发生反应的离子方程式是 ______ .
![]() 测得滤液中
测得滤液中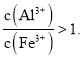 加入
加入![]() 和
和![]() 的作用是
的作用是![]() 结合化学用语说明
结合化学用语说明![]() ______ .
______ .
![]() 将溶液A电解得到液体聚合硫酸铝铁.装置如图所示
将溶液A电解得到液体聚合硫酸铝铁.装置如图所示![]() 阴离子交换膜只允许阴离子通过,电极为惰性电极
阴离子交换膜只允许阴离子通过,电极为惰性电极![]()
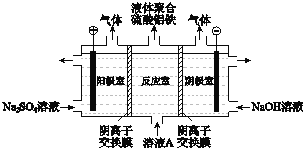
![]() 阴极室的电极反应式是 ______ .
阴极室的电极反应式是 ______ .
![]() 电解过程阳极室溶液pH的变化是 ______
电解过程阳极室溶液pH的变化是 ______ ![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】2008年12月15日,全球第一款不依赖专业充电站的双模电动车--比亚迪F3DM双模电动车在深圳正式上市.比亚迪F3DM双模电动车代表着“科技![]() 绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉
绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉![]() 可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:![]() 有关该电池的说法正确的()
有关该电池的说法正确的()
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应:![]()
C.放电时负极附近溶液的酸性增强
D.放电时电解质溶液中的![]() 向正极移动
向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是________(填字母)。
a.NH3和NO浓度相等
b.NO百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率和写出平衡常数K 的表达式(不必写出计算过程)。
①平衡常数的表达式K=________________;
②平衡时,NH3的转化率α(NH3 )=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入![]() 和
和![]() ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液![]() 滴有几滴酚酞
滴有几滴酚酞![]() 电解实验如图所示。下列说法不正确的是
电解实验如图所示。下列说法不正确的是![]()
![]()
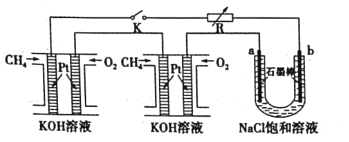
A.甲烷燃料电池正极反应:![]()
B.电解过程中a极附近会出现红色
C.将a、b两极的产物相互反应可得到“84”消毒液的有效成分
D.标况下每个电池甲烷通入量为1L,反应完全,理论上最多能产生氯气8L
查看答案和解析>>
科目: 来源: 题型:
【题目】利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。下列说法不正确的是( )

A.a电极反应式是![]()
B.消耗标准状况下![]() 时,被消除的NO2的物质的量为
时,被消除的NO2的物质的量为![]()
C.若离子交换膜是阳离子交换摸,装置右室中溶液的碱性增强
D.整个装置中NaOH的物质的量不断减少
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是
A.0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA
B.常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA
C.标准状况下,0.1mol氯仿的体积为2.24L
D.11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com