
科目: 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,则下列说法中正确的是
A.2克H2所含的原子数目为NA
B.2molO3和3molO2所含的氧原子数都是6NA
C.常温常压下,11.2L氧气含原子数为NA个
D.2.3g金属钠含有的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是__(填元素符号),电负性最大的是__(填元素符号)。
(2)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道。
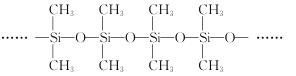
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为__。以甲基硅油为主要成分的硅橡胶能够耐高温的原因是__。
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为__,其含有的共价键类型有__。
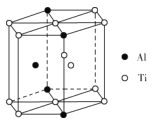
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为__。其结构单元棱长为apm,底面边长为bpm,该合金的密度为___g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如图:
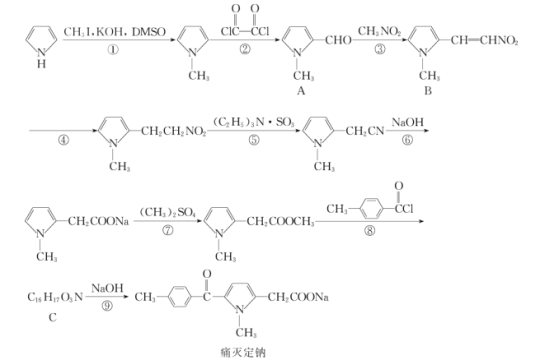
回答下列问题:
(1)化合物B中含有官能团的名称是__。
(2)化学反应①和④的反应类型分别为__和__。
(3)化合物C的结构简式为__。
(4)下列关于痛灭定钠的说法错误的是__。
a.与溴充分加成后官能团种类数不变
b.能够发生水解反应
c.核磁共振氢谱分析能够显示6个峰
d.可使溴的四氯化碳溶液褪色
e.1mol痛灭定钠与氢气加成最多消耗3molH2
(5)反应⑦的化学方程式为__。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:__(不考虑立体异构)。
(7)根据该试题提供的相关信息,写出由化合物![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图。__。
的合成路线图。__。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:
①2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180.5 kJ·mol-1
(1)CO的燃烧热为________。
(2)若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为_____kJ(保留到小数点后一位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。
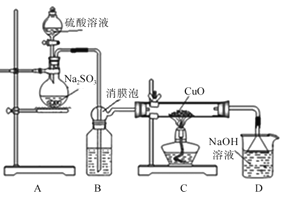
回答下列相关问题:
I.SO2还原CuO的探究
(1)装置B中宜放入的试剂为__,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
II.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为__(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值__(填“偏大”或“偏小”)。为减少实验误差.滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
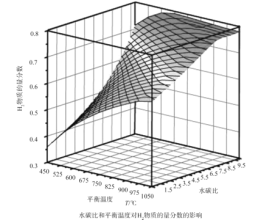
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
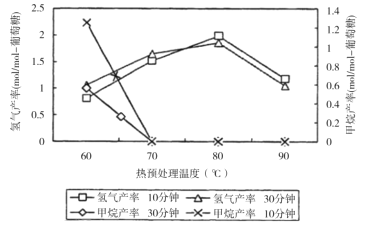
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,甘氨酸在水溶液中主要以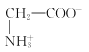 、
、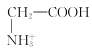 和
和![]() 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
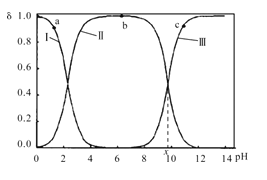
A.a点溶液中,水的电离程度大于b点
B.c点溶液中,c(![]() )>c(
)>c(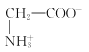 )
)
C.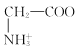 +H2O
+H2O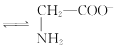 +H3O+的平衡常数为x
+H3O+的平衡常数为x
D.a点溶液中,存在关系式:c(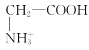 )+c(H+)=c(
)+c(H+)=c(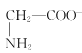 )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )
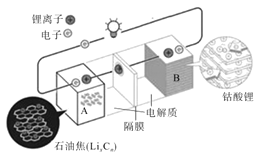
A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,正极反应为LiCoO2-xe-=Li(1-x)CoO2+xLi+
C.放电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
查看答案和解析>>
科目: 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的浓度。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(2)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)数据处理可得c(市售白醋)=_____mol/L。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____(填写字母)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.滴定终点读数时俯视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,原子最外层电子数之和为17。其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
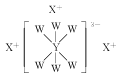
A.原子半径:Z>Y>X>W
B.X与Z形成的化合物会抑制水的电离
C.X、Z均能形成两种常见氧化物
D.W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com