
科目: 来源: 题型:
【题目】镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)硅能形成多种化合物(如SiH4、Si2H4等),SiH4的中心原子的杂化轨道类型为__,其分子的立体构型为__,键角为__;Si2H4分子中含有的σ键和π键的数目之比为__。
(3)Mg、Al的第一电离能:Mg__Al(填“>”或“<”)。
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是__。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为__;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为__g·cm-3(写出表达式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。
回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①CO(g)+2H2(g)=CH3OH(g) △H=-91kJ·mol-1
②2CO2(g)=2CO(g)+O2(g) △H=+566kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
④CO2(g)+3H2(g)=CH3OH(g)+H2O(g)H=__kJ·mol-1。
(2)在容积均为2L的两个恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),有关数据如下:
CO2(g)+H2(g),有关数据如下:

①800°C时该反应的平衡常数K=__。
②容器2中x=__,n=___。
③若800℃起始时,在2L恒容密闭容器中加入CO、H2O、CO2、H2各1mol,则此时v正__v逆(填“>”“<”或“=”)。
(3)反应(NH4)2CO3+H2O+CO2![]() 2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
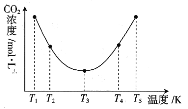
①H__0(填“>”“<”或“=”)。T1~T2区间,c(CO2)变化的原因是___。
②已知常温下NH3·H2O的电离常数K=1.8×10-5,碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则恰好完全反应时所得的NH4HCO3溶液中c(H+)__c(OH-)(填“>”“<”或“=”)。
③在图中所示五种温度下,该反应的平衡常数最大的温度是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】分析下表中的四个热化学方程式,判断氢气和丙烷的标准燃烧热分别是
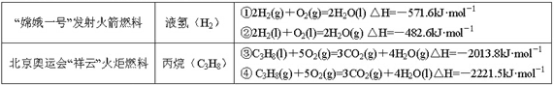
A.-571.6 kJ·mol-1,-2221.5 kJ·mol-1B.-285.5 kJ·mol-1,-2013.8 kJ·mol-1
C.-285.8 kJ·mol-1,-2221.5 kJ·mol-1D.-241.3 kJ·mol-1,-2013.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,总反应为2Na+xS![]() Na2Sx,其反应原理如图所示。下列叙述正确的是( )
Na2Sx,其反应原理如图所示。下列叙述正确的是( )
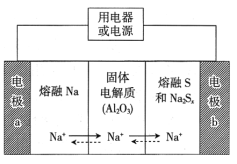
A.放电时,电极a为正极
B.放电时,内电路中Na+的移动方向为从b到a
C.充电时,电极b的反应式为Sx2--2e-=xS
D.充电时,Na+在电极b上获得电子,发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
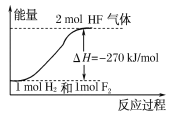
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CaSO4(s)![]() Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
Ca2+(aq)+SO42-(aq) H<0。对含有大量CaSO4(s)的浊液改变一个条件,下列图像符合浊液中c(Ca2+)变化的是( )
A.加入少量BaCl2(s)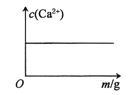
B.加少量蒸馏水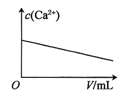
C.加少量硫酸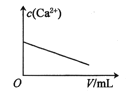
D.适当升高温度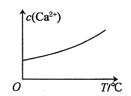
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。
材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1)某研究性学习小组用如图所示试验装置对绿矾的焙烧反应进行探究。
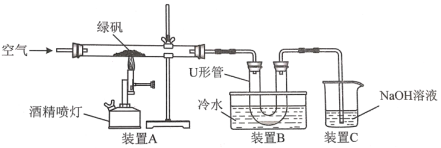
①实验过程中,装置A玻管中可观察到的实验现象是__。
②装置C的作用是__。
③该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入__(填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有SO42-的方法是__。
(2)某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160kg,计算理论上所需绿矾的质量,写出计算过程。___。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇(CH3CH2OH)既是生活中常见的有机物,又是重要的化工原料。
(1)工业上可用乙烯制备乙醇,其反应的化学方程式为:CH2 = CH2+H2O![]() CH3CH2OH,该反应属于__反应(填“加成”或“取代”)。
CH3CH2OH,该反应属于__反应(填“加成”或“取代”)。
(2)官能团决定有机物的性质。乙醇中含有的官能团名称是__。
(3)为探究乙醇的性质,某学生向试管中加入3mL乙醇,将下端绕成螺旋状的铜丝在酒精灯火焰上灼烧至红热后,迅速插入乙醇中,可观察到铜丝表面由黑色变成红色,说明乙醇具有__性。
(4)萃取是物质分离的一种方法。某学生拟用乙醇萃取溴水中的Br2,判断该方法是否可行:__(填“是”或“否”),判断的理由是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
【1】为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素![]() Md的质量数为( )
Md的质量数为( )
A.101B.157C.258D.359
【2】Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是( )
A.质子数B.电子层数C.核外电子数D.最外层电子数
【3】判断Cl的非金属性比S的强,可依据的事实是( )
A.HCl的热稳定性比H2S的强B.氯气能溶于水,硫难溶于水
C.常温下,氯单质呈气态,硫单质呈固态D.AgCl是白色固体,Ag2S是黑色固体
【4】锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )
A.最高化合价为+2B.原子半径比钠的大
C.单质与水的反应比钠更剧烈D.最高价氧化物对应的水化物碱性比钠的弱
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
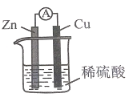
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com