
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
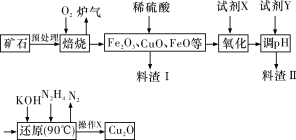
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________(填化学式),Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,则“氧化”反应的离子方程式为____________________,并写出H2O2的电子式:__________;当试剂X是__________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是__________。
(4)操作X包括__________、洗涤、烘干,其中烘干时要隔绝空气,其目的是_________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)2C(g);ΔH>0(表示吸热)。平衡移动关系如图所示,下列说法正确的是( )
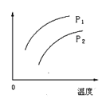
A.P1>P2,纵坐标指C的质量分数B.P1<P2,纵坐标指A的质量分数
C.P1<P2,纵坐标指A的转化率D.P1<P2,纵坐标指混合气体的平均摩尔质量
查看答案和解析>>
科目: 来源: 题型:
【题目】通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是( )
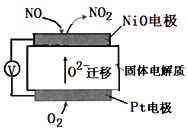
A.O2-由负极向正极移动
B.负极的电极反应式为:NO-2e-+O2-=NO2
C.O2在电极上的还原产物是H2O
D.反应消耗的NO与O2的物质的量之比为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH﹣△H>0,下列叙述正确的是( )
H++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
C.向水中加入金属钠,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时,Ksp(Ag2S)=6.3×10-50、Ksp(AgCl)=1.5×10-16。某研究性学习小组探究AgCl、Ag2S沉淀转化的原因。
步骤 | 现象 |
Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 在空气中放置较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是__。
(2)Ⅱ中能说明沉淀变黑的离子方程式是__。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,沉淀部分溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y中滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是__。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀__。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
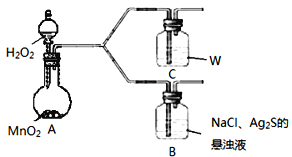
现象 | B:一段时间后,出现乳白色沉淀 |
C:一段时间后,无明显变化 |
①A中产生的气体是___。
②C中盛放的物质W是__。
③该同学认为B中产生沉淀的反应如下(请补充完整):__
2Ag2S+__+__+2H2O=4AgCl+__+4NaOH
④从溶解平衡移动的角度,解释B中NaCl的作用__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于溶液物质的量浓度的说法正确的是( )
A.常温下,1L水中溶解58.5gNaCl,该溶液的物质的量浓度为1molL﹣1
B.标准状况下,将22.4L HCl溶于1L水,可配成1molL﹣1的稀盐酸
C.将4.0g NaOH倒入100mL容量瓶中,加水至刻度线,即可配成1molL﹣1的NaOH溶液
D.10g 98%的硫酸(密度为1.84gcm﹣3)与10mL 18.4molL﹣1的硫酸的浓度相同
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废液(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如图:
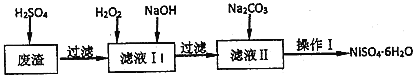
已知: 25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有________。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液I中加入6%的H2O2,其作用是__________(用离子方程式表示);加入NaOH调节pH的范围是_________,为了除去溶液中的_________离子。
(3)检验Ni2+已完全沉淀的实验方法是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷、硼、砷的化合物用途非常广泛。根据所学知识回答下列问题:
(1)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a、b、c、d、e对应元素电负性最大的是__(用元素符号表示),e点代表的第三周期某元素的基态原子核外电子占据的最高能层符号为__,该能层具有的原子轨道数为__。

(2)已知反应:(CH3)3C-F+SbF5→(CH3)3CSbF6,该反应可生成(CH3)3C+,该离子中碳原子杂化方式有__。
(3)一种新型储氢化合物氨硼烷是乙烷的等电子体,且加热氨硼烷会慢慢释放氢气,推断氨硼烷的结构式为__(若含有配位键,要求用箭头表示)。
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为__;正四面体形阳离子中键角大于PCl3的键角原因为___。
(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B:(0,0,0);(![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() )
)
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() )
)
①请在图中画出砷化硼晶胞的俯视图__。

②与砷原子紧邻的硼原子有__个,与每个硼原子紧邻的硼原子有__个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com