
科目: 来源: 题型:
【题目】取纯净![]() 固体用如下方法制备
固体用如下方法制备![]() 。
。
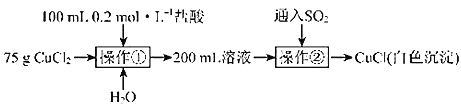
(4)操作②中反应的离子方程式为_________。
(5)操作①中若用![]() 盐酸代替
盐酸代替![]() 盐酸,再通入
盐酸,再通入![]() 后,无白色沉淀产生。对此现象有如下两种猜想:
后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:![]() 过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、
过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、![]() 盐酸及________
盐酸及________![]() 配制
配制![]() 溶液,再进行操作②,观察是否有白色沉淀产生。
溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:____________。为验证此猜想,取少量白色沉淀加入饱和氯化钠溶液中,搅拌,观察白色沉淀是否溶解。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加___溶液,溶液颜色无明显变化,由此可知样品中无Fe3+。
(2)为测定绿矾中结晶水含量,称石英玻璃管(带开关K1和K2)(设为装置A)的质量,记为m1g。将样品装入石英玻璃管中,再次称其质量,记为m2g。按如图连接好装置进行实验。

①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填字母);重复上述操作步骤,直至A质量不变,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式,结晶水数目x=___。若实验时按a、d次序操作,则使x___(填偏大偏小或无影响)。
(3)为探究硫酸亚铁的分解产物,将(2)中已质量不变的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
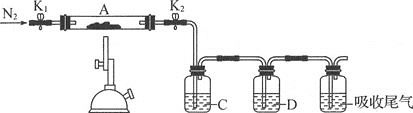
①C、D中的溶液依次为___(填字母),可观察到C、D中有气泡冒出。
a.品红 b.NaOH C.BaCl2 d.Ba(NO3 )2 e.浓硫酸
②写出硫酸亚铁高温分解反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】加碘食盐中含碘酸钾(KIO3),化学兴趣小组对加碘食盐展开研究性学习。
(1)加碘食盐中KIO3的制备可以采用以下两种方法:
方法一:碘单质与KClO3溶液反应生成KIO3和Cl2;
方法二:碘单质与H2O2在催化剂作用下反应生成HIO3,再与K2CO3作用生成KIO3;两种方法制等质量的KIO3,理论上消耗KClO3和H2O2的物质的量之比为 _______ 。
(2)兴趣小组测定食用精制盐中碘元素含量的实验步骤为:
步骤1:准确称取25.00 g食盐,加适量蒸馏水使其完全溶解,配成100.00 mL溶液;
步骤2:取所配溶液25.00 mL于锥形瓶中,用稀硫酸酸化该溶液,加入足量KI溶液,使之充分反应;
步骤3:滴入2~3滴淀粉溶液作指示剂,用1.0×10-3 mol·L-1的Na2S2O3标准溶液滴定至终点,恰好完全反应时消耗12.00 mL标准溶液。
已知步骤3中所发生反应的离子方程式为I2+2S2O32-=2I-+S4O62-。
①步骤3中滴定终点的现象是 _______ 。
②下列情况会使测定结果偏大的是 _______ 。
A 装Na2S2O3标准溶液的滴定管水洗后未用Na2S2O3标准溶液润洗
B 装Na2S2O3标准溶液的滴定管滴定前有气泡,滴定终了无气泡
C 滴定时未充分振荡,溶液局部变色就终止
D 若其他读数正确,滴定结束读数时俯视
③计算该精制盐的碘元素含量(mg·kg-1),写出计算过程_______。
查看答案和解析>>
科目: 来源: 题型:
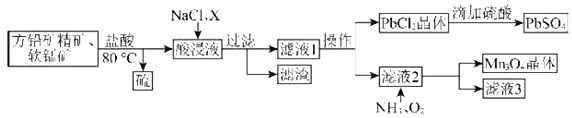
【题目】用方铅矿精矿(主要为![]() )和软锰矿(主要为
)和软锰矿(主要为![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)制备
等杂质)制备![]() 和
和![]() 的工艺流程如图:
的工艺流程如图:
已知:①![]() 。
。
②![]() 。
。
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是____________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_____________;加入物质X可用于调节酸浸液的![]() 值,物质X可以是___________(填字母)。
值,物质X可以是___________(填字母)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)滤渣中含有两种金属杂质形成的化合物,其成分为___________(写化学式)。
(4)向滤液2中通入![]() 和
和![]() 发生反应,写出总反应的离子方程式:________________。
发生反应,写出总反应的离子方程式:________________。
(5)用![]() 为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
A.热还原法 B.电解法 C.热分解法
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
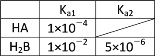
①25℃时,0.100 mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是: _______ 。pH=8的 NaA溶液中由水电离出的c(OH-)= _______ mol·L-1。
②25℃时,0.100 mol·L-1的NaHB溶液pH _______ 7,理由是 _______ 。
③25℃时,向0.100 mol·L-1的Na2B溶液中滴加足量0.100 mol·L-1的HA溶液,反应的离子方程式为_______ 。
(2)已知25℃时,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
①25℃,pH=3时溶液中c(H3PO4)∶c(H2PO![]() )=_______ 。
)=_______ 。
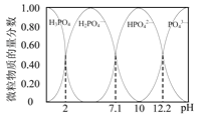
②当溶液pH由11到14时,所发生反应的离子方程式为:_______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g) =2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH= _______ kJ·mol-1
2NH3(g) ΔH= _______ kJ·mol-1
(2)以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨方面取得了突破性进展。其工作原理如图所示:
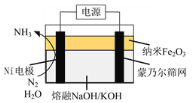
①Ni电极处发生的总反应为: N2+6e-+6H2O=2NH3+6OH-
已知该反应分为两步,其中第二步的反应为2Fe+3H2O+N2=2NH3+Fe2O3,则第一步反应为 _______ 。
②蒙乃尔筛网处发生的电极反应为: _______ 。
(3)NH3可以合成尿素,反应为2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
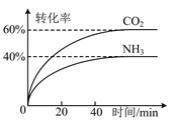
①下列情况能说明反应达到平衡状态的是 _______ 。
A NH3和CO2的物质的量之比为2∶1
B 容器内气体的密度保持不变
C 2v正(NH3)=v逆(CO2)
D 各气体的体积分数保持不变
②起始时NH3和CO2的物质的量之比为 _______ 。
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,则达到新平衡时NH3的体积分数为 _______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示。下列溶液中离子浓度关系正确的是
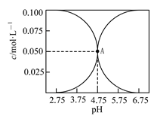
A.c(Na+)=0.1 mol·L-1的溶液中: c(H+)+c(CH3COOH)=c(OH-)
B.点A溶液中:c(Na+)>c(CH3COOH)
C.pH=3.5的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.c(CH3COO-)=0.025 mol·L-1的溶液中:3c(Na+)<c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示:
的系统,借助锂循环可持续合成氨,其原理如图所示:
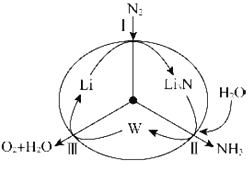
(1)过程Ⅰ得到Li3N的电子式为___________。
(2)过程Ⅱ生成W的化学反应方程式为____________。
(3)实验室制取氨气的化学反应方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com