
科目: 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:
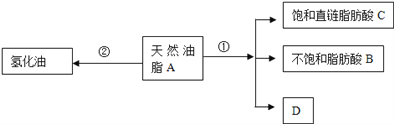
已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
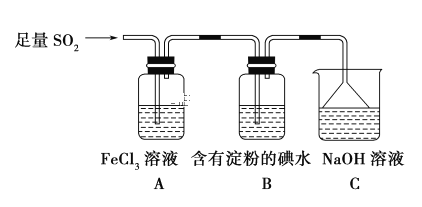
(1)装置C的作用是 ______________________。
(2)在上述装置中通入过量的SO2,请设计实验验证A中SO2与Fe3+发生了氧化还原反应: __________________。
(3)通入气体后B装置中观察到的现象是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目: 来源: 题型:
【题目】用无水Na2CO3固体配制250mL 0.1000mol·L-1的溶液。请回答:
(1)在配制过程中用到的仪器是______(填序号)。
A.烧杯 B. 托盘天平 C.玻璃棒 D.胶头滴管 E.容量瓶
(2)需要无水Na2CO3的质量______克。
(3)定容时的操作:当液面接近容量瓶刻度线________cm时改用__________(胶头滴管、烧杯、试管)再将容量瓶塞盖好,反复上下颠倒,摇匀。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色澄清溶液中Cl-浓度为0.5 mol·L-1,还可能含有下表中的若干种离子。
阳离子 | K+、Al3+、Mg2+、Ba2+、Fe3+ |
阴离子 | NO3-、CO32-、SiO32-、SO42-、OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)通过以上实验不能确定是否存在的离子有______________。能确定一定不存在的离子是_____________________________________________________。
(2)实验Ⅰ中生成沉淀的离子方程式为_____________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子______________ (不一定要填满)。
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,![]()
![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液![]() ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
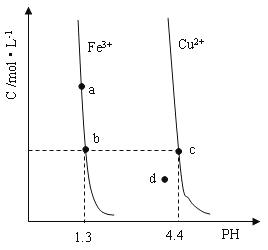
A.![]()
B.加适量![]() 固体可使溶液由
固体可使溶液由![]() 点变到
点变到![]() 点
点
C.![]()
![]() 两点代表的溶液中
两点代表的溶液中![]() 与
与![]() 乘积相等
乘积相等
D.![]() 、
、![]() 分别在
分别在![]() 、
、![]() 两点代表的溶液中达到饱和
两点代表的溶液中达到饱和
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
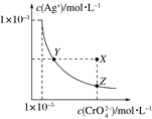
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)配平下列方程式
①_____Na+_____H2O =_____NaOH+_____H2↑
②_____Na2O2 +_____ CO2=_____ NaCO3 +_____O2↑
③_____KMnO4 +_____HCl(浓) =_____ KCl +_____MnCl2 +_____H2O + _____Cl2↑
④_____Al+_____H2O +_____NaOH =_____Na AlO2 +_____H2↑
(2)用双线桥法表示电子转移的数目和方向____________、__________
①2Na2O2 + 2H2O = 4NaOH + O2↑
②2FeCl2 + Cl2 = 2FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com