
科目: 来源: 题型:
【题目】以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:

上述装置工作时,下列有关说法正确的是
A. Na+由乙池穿过交换膜进入甲池
B. 甲池电极反应:4CO32-+2H2O-4e-=4HCO3-+O2↑
C. 乙池电极接电池正极,气体X为H2
D. NaOH溶液Y比NaOH溶液Z浓度小
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
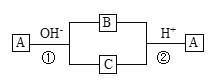
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的分类或归类正确的是
A.化合物:CaCl2、烧碱、聚苯乙烯、HD
B.电解质:明矾、胆矾、冰醋酸、硫酸钡
C.同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
D.同位素:![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】吗氯贝胺是一种治疗抑郁症的药物,其中一种合成路线及相关转化如图所示:
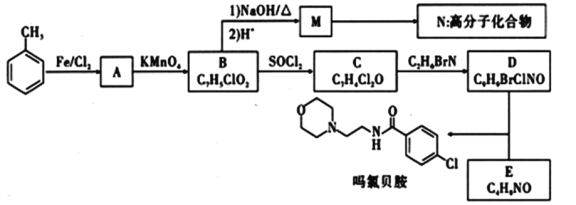
已知信息:①、![]()
②![]() +HCl
+HCl
(1)B的名称_____。
(2)C的结构简式______;A到B的反应类型为______;D中含氧官能团的名称_____。
(3)请写出形成N高分子化合物的方程式________。
(4)写出由D和E反应生成吗氯贝胺的方程式_______。
(5)物质I比C的相对原子质量大14,符合下列条件I的同分异构体有__种。
①能发生银镜反应 ②苯环上有三个取代基
(6)结合以上合成路线信息,设计以CH3-![]() -CH3和CH3-CH2-NH2为原料(无机试剂任选),合成有机物
-CH3和CH3-CH2-NH2为原料(无机试剂任选),合成有机物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目: 来源: 题型:
【题目】羟氨(NH2OH)是一种还原剂,和联氨一样是一种弱碱,不稳定,室温下吸收水汽迅速分解。回答下列问题:
(1)请写出羟氨的电子式___。
(2)利用KMnO4标准溶液定量间接测定羟氨的纯度。测定步骤如下:
①溶液配制:称取5.0g某羟氨样品,溶解在______酸中后加适量蒸馏水,将其全部转移至100mL的______中,加蒸馏水至_______。
②取20.00mL的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应:2NH2OH2++4Fe3+=N2O↑+4Fe2++H2O+6H+,生成的Fe2+用0.4000 mol·L-1的酸性KMnO4溶液滴定,滴定达到终点的现象是____________。请写出Fe2+与酸性KMnO4溶液反应的离子方程式_____________。重复滴定3次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
![]()
计算试样的纯度____%。
(3)下列操作导致误差偏高的有______(填编号)。
a 滴定前滴定管尖嘴处有气泡,滴定后消失
b 滴定管未经润洗盛装KMnO4溶液
c 羟氨称量时,时间过长和溶解时没有及时用酸酸化
d KMnO4溶液起始读数仰视,终点正常读数
查看答案和解析>>
科目: 来源: 题型:
【题目】铁在史前就为人们所知,由于铁、钴、镍性质很相似故称为铁系元素。回答下列问题:
(1)铁、钴、镍中未成对电子数目最多的为_____,镍的外围电子轨道表达式为_____。
(2)Co2+可以和SCN-作用形成蓝色配离子,该反应可用于Co2+的定性检验。
①SCN-的空间构型为____,组成元素中第一电离能最大的是___。
②SCN-对应的酸有硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中后者沸点较高,主要原因是_________________。
(3)二茂铁是一种夹心式结构的配合物,通常认为是由一个Fe2+离子和两个C5H5-离子形成的,X射线研究结果指出两个C5H5-环的平面是平行的,结构如图1所示。C5H5-中碳原子的杂化类型为_____。分子中的大π键盘可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
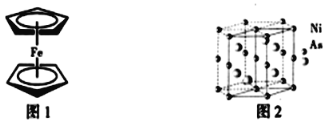
(4)NiAs晶体中的原子堆积方式如图2所示,其中As的配位数为______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,NiAs的密度为______g·cm-3,(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应是放热反应
B. 该反应的ΔH=-(E1-E2) kJ· mol-1
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯是仅次于乙烯的有机化工原料,可由丙烷脱氢氧化制取。丙烷脱氢氧化工艺包含的反应有:
主反应:①C3H8(g)![]() C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
②H2(g)+![]() O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
副反应:③C3H8(g)![]() CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
④C2H4(g)+H2(g)![]() C2H6(g) △H4=-136.94 kJ·mol-1
C2H6(g) △H4=-136.94 kJ·mol-1
⑤C3H8(g)+H2(g)![]() CH4(g)+C2H6(g) △H5
CH4(g)+C2H6(g) △H5
回答下列问题:
(1)△H5=____kJ·mol-1。
(2)图1是制备工艺中一些反应平衡常数的对数值与温度的关系图,欲提高丙烯的产率,能否尽可能的提高反应温度?_________,其原因是__________________。除温度外,下列还可提高丙烯产率的措施有_________(填序号)

A 降低压强 B 增大压强
C 采用选择性优良的催化剂 D 选择性的氧化消除部分氢气
(3)实际脱氢工艺中常常通入水蒸汽,以改变丙烷的平衡转化率。图2为常压、600~1000K时,不同水烃比M下丙烷脱氢反应的平衡转化率变化图。由图可知,常压、温度恒定时水烃比对平衡转化率的影响规律为____________。设某温度、1 atm(记为p0)下丙烷的脱氢转化率为y,加入反应体系的水蒸汽与原料丙烷的物质的量之比为M,则脱氢反应的平衡常数Kp=____(Kp为以分压表示的平衡常数,写出表达式即可)。
(4)当反应温度为923K时,计算可知脱氢反应的反应热为+115.66 kJ·mol-1,烧氢反应的反应热为-237.75 kJ·mol-1,为保证烧氢所放热量完全满足脱氢吸热之用(假设脱氢率为100%),则烧氢率应大于_____;由此可见,烧氢过程不仅可以提高丙烷脱氢的转化率,还可以_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应aA(g)+bB(g)![]() cC(g)+dD(g),反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图。下列叙述不正确的是
cC(g)+dD(g),反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图。下列叙述不正确的是
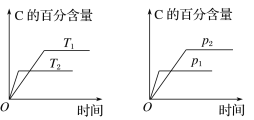
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化剂,则C的百分含量不变
C.化学方程式中a+b>c+d
D.达平衡后,减小A的量有利于平衡向左移动
查看答案和解析>>
科目: 来源: 题型:
【题目】 恒温恒压下,在容积可变的器皿中,反应2NO2 (g)![]() N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.减小 B.增大 C.不变 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com