
科目: 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
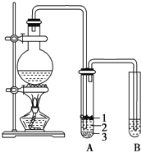
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸。配制体积比1:1的硫酸所用的仪器为 ________(选填编号)。
a 天平 b 量筒 c 容量瓶 d 烧杯
(2)写出加热时烧瓶中发生的主要反应的化学方程式 ___________________ 。
(3)将 生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________,试管A中的物质分为三层(如图所示),产物在第____层。
(4)试管A中除了产物和水之外,还可能存在 ________ ,_________ (写出结构简式)。
(5)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的最佳方法是 ___________(选填编号)。
a 蒸馏 b 氢氧化钠溶液洗涤 c 用四氯化碳萃取 d 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质名称是_________。
(6)实验员老师建议把上述装置中的仪器连接部分由橡胶管改成标准玻璃接口,其原因_________。
查看答案和解析>>
科目: 来源: 题型:
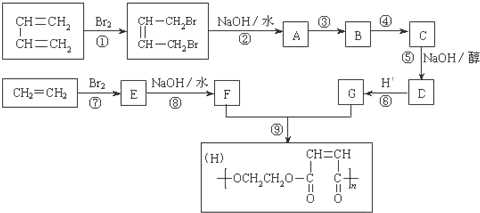
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)
请按要求填空:
(1)写出下列反应的反应类型:反应① ___________ ; 反应⑤ ___________ 。
(2)反应②的化学方程式是:__________ 。
(3)反应③、④中有一反应是与HCl加成,该反应是______(填反应编号),设计这一步反应的目的是_____,物质C的结构简式是_____。
(4)写出与G具有相同种类和数目的官能团的同分异构体:________。
(5)写出由甲苯合成苯甲醛的合成路线________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源。根据下列图示有关说法正确的是
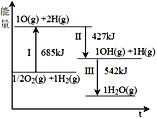
A.断开非极性键和生成极性键的能量相同
B.反应II比反应III生成的O-H键更牢固
C.1/2O2(g) +H2(g) → OH(g) + H(g) ΔH1>0
D.H2O(g)→ 1/2O2(g) +H2(g) ΔH2<0
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答问题:
① | |||||||
② | |||||||
③ | ④ | ⑤ | |||||
⑥ |
(1)①和②形成的最简单化合物的结构式是__________,该分子的空间构型是________。
(2)⑤元素位于元素周期表 ___ ,最外层电子的排布式 _________ ,原子核外有 _______种能量不同的电子。CCl4 是一种常见的有机溶剂,判断其属于 _______ (填“极性”、“非极性”)共价键,_________ 分子(填“极性”、“非极性”)。
(3)某元素3P亚层上只有一个电子,判断其离子与②,⑤离子半径大小 ______ (用微粒符号表示),写出该元素单质与元素③最高价氧化物对应水合物反应的化学方程式:________。
(4)设计一个实验方法:比较⑤与⑥单质氧化性的强弱,填入下表。
实验步骤 | ________ |
实验现象 | ________ |
实验原理 | ________ |
实验结论 | ________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a 减压 b 增加NH3的浓度 c 升温 d 及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式__________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_________。其中氮元素原子最外层电子排布的轨道表达式是___________。通过比较_____________可判断氧,硫两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是________。CS2熔点高于CO2,其原因是 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液均为![]() ,有关叙述正确的是( )
,有关叙述正确的是( )
A.碳酸氢钠溶液中![]()
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中![]()
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
B | B原子最外层电子数是内层电子总数的1/5 | |
③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为____________________________________________。
(2)B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是____________________
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱____。
(5)有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1NaHCO3溶液:K+、Al3+、NO3-、SO42-
B.![]() 10-12的溶液中:Na+、K+、ClO-、CO32-
10-12的溶液中:Na+、K+、ClO-、CO32-
C.能使红色石蕊试纸变蓝的溶液:NH4+、K+、Cl-、NO3-
D.水电离的c(H+)=10—11mol·L-1的溶液中:Na+、Ca2+、HCO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予美国和日本的三位科学家,以表彰他们在锂离子电池领域的贡献。某种锂离子电池的工作原理如图所示,工作原理为:LiCoO2+C6![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
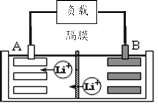
(1)该锂离子电池工作时A为____极,B的电极反应式为____。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过实验方法回收钴、锂,实现废旧电池的资源化。
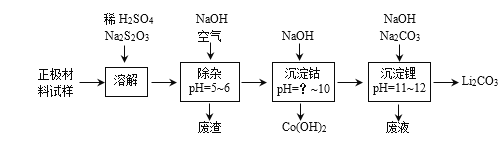
下表列出了几种离子生成氢氧化物沉淀的pH(“开始沉淀”的pH按金属离子浓度为0.1mol·L-1,“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1):
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | ? |
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
②除杂过程中,通空气将Fe2+氧化为Fe3+的目的是____。
③沉钴过程中,须调节溶液的pH不低于____。
查看答案和解析>>
科目: 来源: 题型:
【题目】比较下列各项中的前者和后者,用“>”、 “<”或“=”填空
(1)熔点:NaCl_______CaO
(2)沸点: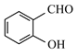 ____
____![]()
(3)在水中的溶解度:SO2_____CO2
(4)酸性:H3PO3_________H3PO4
(5)键能:H—O______ H—S
(6)价电子数:O________Cr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com