
科目: 来源: 题型:
【题目】室温下,将稀盐酸和一元碱BOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:

请回答:
(1)HCl溶液和BOH溶液反应的离子方程式为___________________;
(2)实验①反应后的溶液中由水电离出的c(OH-)=_________mol·L-1;实验③反应后的溶液中由水电离出的c(OH-)=_________mol·L-1
(3)x_________0.2 mol·L-1(填“>”“<”或“=”;)
查看答案和解析>>
科目: 来源: 题型:
【题目】酸碱中和滴定原理也用在其他物质滴定,例如:下面是某化学学习小组的同学对草酸晶体进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值通过查阅资料知得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取2.52 g纯草酸晶体,将其配制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。问:
(1)通过上述数据,计算x=_____________。
(2)滴定终点时俯视滴定管刻度,则由此测得的x值会_______(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,等容密闭容器中进行可逆反应:A(g)+2B(s)![]() 3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
A.A、B、C的分子数目比为1:2:3B.容器内压强不再变化
C.单位时间生成lmolA,同时消耗2molBD.C的生成速率与C的分解速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是_________(用离子方程式表示)
(2)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_________________。
(3)室温下将0.12 mol/L HCl溶液与0.1 mol/L NaOH溶液等体积混合,混合液的pH=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个化学过程的示意图,回答下列问题:
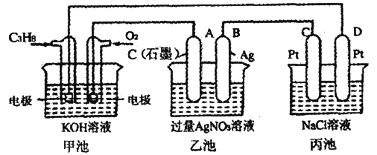
(1)甲池是___________装置,电极B的名称是___________。
(2)甲装置中通入C3H8的电极反应____________,丙装置中D极的产物是___________(写化学式)。
(3)一段时间,当乙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=__________。(已知:NaCl溶液足量,电解后溶液体积为200 mL)。
(4)若要使乙池恢复电解前的状态,应向乙池中加入__________(写物质化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以烯烃为原料,合成某些高聚物的路线如图:

已知:Ⅰ.![]() (或写成
(或写成![]() R代表取代基或氢)
R代表取代基或氢)
Ⅱ.甲为烃
Ⅲ.F能与NaHCO3反应产生CO2请完成以下问题:
(1)CH3CH=CHCH3的名称是______,Br2的CCl4溶液呈______色.
(2)X→Y的反应类型为:______;D→E的反应类型为:______.
(3)H的结构简式是______.
(4)写出下列化学方程式:
A→B______;
Z→W______.
(5)化工生产表明高聚物H的产率不及设计预期,产率不高的原因可能是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I.已知:①N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
②CO的燃烧热△H=-283 kJ·mol-1。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为________________________________。
(2)一定温度下,在恒容密闭容器中充入1 mol NO和2 mol CO进行该反应,下列不能判断反应达到化学平衡状态的是___________(用序号填空)
①单位时间内消耗a mol CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
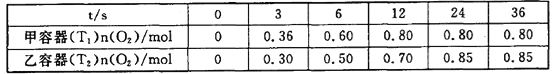
(3)T1______T2(填>、<或=,下同),该反应△H________0。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=________。
(5)甲容器中NO2平衡转化率为__________,T1时该反应的平衡常数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO47H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO47H2O。
(4)硫酸亚铁铵[(NH4)2SO4FeSO46H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2B溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ表示H2B,Ⅱ代表HB-、Ⅲ代表B2-),根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是
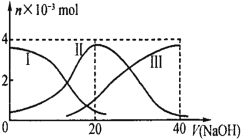
A. c(Na+)>c(HB-)>c(H+)>c(B2-)>c(H2B)
B. c(Na+)>c(HB-)>c(OH-)>c(H2B)>c(H+)>c(B2-)
C. c(Na+)>c(H+)>c(HB-)>c(B2-)>c(OH-)>c(H2B)
D. c(Na+)>c(OH-)>c(HB-)>c(H2B)>c(H+)>c(B2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
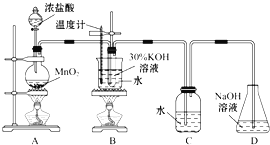
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com