
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.71gCl2溶于足量水中,Cl-的数量为NA
B.46g乙醇中含有共价键的数量为7NA
C.25℃时,1LpH=2的H2SO4溶液中含H+的总数为0.02NA
D.标准状况下,2.24LCO2与足量Na2O2反应转移的电子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是

A. 阳极的电极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染等行业。以硫化铜精矿为原料生产CuCl的工艺如图:
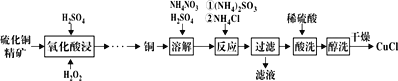
已知CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+Cl-![]() CuCl2-],潮湿空气中易水解氧化。
CuCl2-],潮湿空气中易水解氧化。
(1)“氧化酸浸”前先将铜矿粉碎的目的是__。该过程生成蓝色溶液和浅黄色沉淀,则反应的化学反应方程式为__;
(2)“溶解”时所用硫酸浓度为0.3mol·L-1,配制1L此硫酸溶液,需要98%、1.84g·mL-1浓硫酸__mL(保留1位小数)。溶解时反应的离子方程式__;
(3)“反应”时,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。
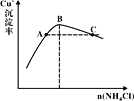
①反应的氧化产物是___,n(氧化剂):n(还原剂)=___;
②比较c(Cu+)相对大小:A点___C点(填“>”、“<”或“=”)。
③提高处于C点状态的混合物中Cu+沉淀率措施是___;
(4)“过滤”所得滤液中溶质主要成分的化学式为__;
(5)不能用硝酸代替硫酸进行“酸洗”,理由是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校学习小组的同学设计实验,制备(NH4)2Fe(SO4)26H2O并探究其分解规律。实验步骤如下:
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)26H2O。
V.将(NH4)2Fe(SO4)26H2O脱水得(NH4)2Fe(SO4)2,并进行热分解实验。
已知在不同温度下FeSO47H2O的溶解度如表:
温度(℃) | 1 | 10 | 30 | 50 |
溶解度(g) | 14.0 | 17.0 | 25.0 | 33.0 |
回答下列问题:
(1)步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是__,步骤Ⅱ中设计铁粉过量,是为了__,加热反应过程中需不断补充蒸馏水的目的是__。
(2)步骤Ⅲ中称量反应后剩余铁粉的质量,是为了__。
(3)(NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。

①检验气态产物中的SO2和SO3时,装置连接顺序依次为__(气流从左至右);C中盛放的试剂为__。
②装置A的作用是__。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
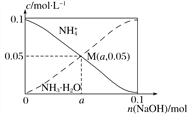
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用,苯氧布洛芬的合成路线如下:
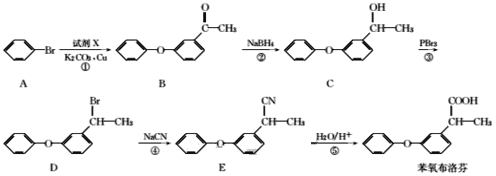
回答下列问题:
(1)苯氧布洛芬中官能团的名称为___。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A-D四种物质中,含有手性碳的有机物为___(填字母)。
(3)反应②的反应类型是___。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为___。
(5)有机物M与C互为同分异构体,M满足下列条件:
I.能与FeCl3溶液发生显色反应,1molM可消耗2molNaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3:2:2:2:2:3,且分子中含有![]() 结构。
结构。
M的结构有___种,写出其中一种结构简式:___。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2一甲基丙酸的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
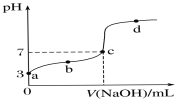
A.a点表示的溶液中c(H+)等于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(![]() ),发生反应:
),发生反应:![]()
![]()
![]() ,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
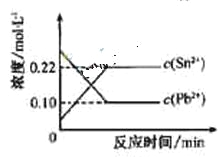
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量![]() 固体后,c(Sn2-)变小
固体后,c(Sn2-)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应![]()
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目: 来源: 题型:
【题目】在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在2s时体系内的压强为开始时的1.1倍
C.在平衡时体系内N2O4的物质的量为0.25mol
D.平衡时,N2O4的转化率为40%
查看答案和解析>>
科目: 来源: 题型:
【题目】(卷号)10000
(题号)2427322248593408
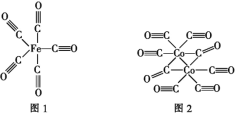
钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为____,Co的第四电离能比Fe的第四电离能要小得多,原因是____。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
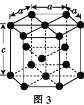
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为anm,高为cnm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com