
科目: 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)丙酮(CH3COCH3)分子中2号碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___mol。
(2)C、H、O三种元素的电负性由小到大的顺序为__。(请填写元素名称,不要加任何连接符号)
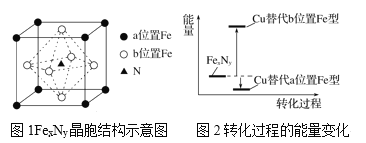
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠和铜的单质及其化合物在社会实际中有着广泛的应用。
(1)NaCl晶体的晶胞结构如图所示,每个NaCl的晶胞中含有的阴离子的个数为__,阳离子周围最近且等距离得阴离子的个数为__。
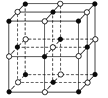
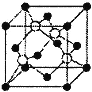
(2)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如右图所示,则A的化学式是__,A中铜元素的化合价为__。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过___键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是__。与NH3分子互为等电子体的一种阳离子是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的制备中,不符合工业生产实际的是
A.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
B.浓缩海水![]() Br2
Br2![]() HBr
HBr ![]() Br2
Br2
C.饱和食盐水![]() Cl2
Cl2![]() 漂白粉
漂白粉
D.H2和Cl2混合气体![]() HCl气体
HCl气体![]() 盐酸
盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似,物理性质也相近。以下各组粒子能互称为等电子体的是( )
A. O3和SO2 B. CO和N2 C. CO和NO D. N2H4 和C2H4
查看答案和解析>>
科目: 来源: 题型:
【题目】2010年10月5日17时45分,瑞典皇家科学院宣布,将2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子(结构如图所示).将氢气加入到石墨烯中开发出一种具有突破性的新材料石墨烷,下列说法中正确的是( )

A.石墨烯是高分子化合物
B.石墨烯与石墨烷互为同素异形体
C.一定条件下石墨烯可与H2发生加成反应
D.根据结构示意图可知,石墨烯不能导电
查看答案和解析>>
科目: 来源: 题型:
【题目】通常把原子总数和价电子总数相同的分子或离子称为等电子体.人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.B3N3H6分子中存在双键,可发生加成反应
B.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
C.NH3和PCl3是等电子体,均为三角锥形结构
D.BF3和CO![]() 是等电子体,均为平面正三角形结构
是等电子体,均为平面正三角形结构
查看答案和解析>>
科目: 来源: 题型:
【题目】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是( )
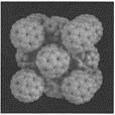
A. C60摩尔质量是720
B. C60与苯互为同素异形体
C. 在C60晶胞中有14个C60分子
D. 每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.Na、Mg、Al的未成对电子数依次增多
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
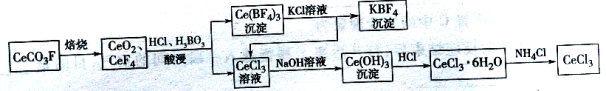
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为 。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式: 。
(3)向Ce(BF4)3中加入KCl溶液的目的是 。
(4)溶液中的C(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,此时溶液的PH为 。(已知KSP[Ce(OH)3]=1×10-20)
(5)加热CeCl3 .6H2O和NH4Cl的固体混合物可得到无水CeCl3 ,其中NH4Cl的作用是 。
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0.1000mol.l-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00ml标准溶液。(已知:Fe2++Ce4+=
Ce3++Fe3+)
①该样品中CeCl3的质量分数为 。
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数 (填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com