
科目: 来源: 题型:
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】Cl2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.
完成下列填空:
(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.
(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.
(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO的杀菌能力比ClO﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).
(4)在氯水中,下列关系正确的是__(选填编号).
a c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)
b c(H+)=c(ClO﹣)+c(Cl﹣)+c(OH﹣)
c c(HClO)<c(Cl﹣)
d c(Cl﹣)<c(OH﹣)
(5)ClO2是一种更高效、安全的消毒剂,工业上可用ClO2与水中的MnCl2在常温下反应,生成MnO2和盐酸,以除去水中Mn2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
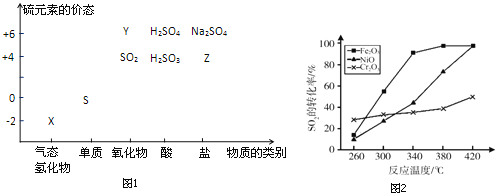
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关常温下0.1 mol/L氨水(pH=11)的说法正确的是
A.该氨水显弱碱性
B.加水稀释过程中,![]() 的值减小
的值减小
C.与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+)
D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O![]() H+ + OH―向右移动
H+ + OH―向右移动
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后达平衡状态,此时测得D的浓度为0.5mol/L,混合气体的总体积为134.4L(标准状况),C的平均反应速率为0.1mol/(L·min)。试求:
(1)此时C的浓度c(C)=__________mol/L,x的值为___________;
(2)反应开始前容器中的A.B的物质的量:n(A)=n(B)=________mol;
(3)A的平均反应速率为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】与下列事实对应的化学用语错误是( )
A.纯碱溶液能清洗油污:CO32﹣+H2OHCO3﹣+OH﹣
B.配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+
C.含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
D.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42﹣恰好沉淀完全:2Ba2++4OH﹣+Al3++2SO42﹣→2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四组物质,用横线上所给的试剂常温下就能鉴别出来的是( )
A.FeO、FeS、CuO、CuS、稀硫酸
B.苯、四氯化碳、无水乙醇、己烯 溴水
C.甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液
D.苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2OH4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
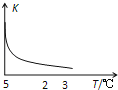
A.该反应平衡常数的表达式为K=c(H4SiO4)
B.该生成H4SiO4的反应为吸热反应
C.用H4SiO4表示的反应速率为1.04×10﹣2mol/(Lh)
D.若K值变大,在平衡移动时逆反应速率先减小后增大
查看答案和解析>>
科目: 来源: 题型:
【题目】饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是( )
A.该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl
B.母液中通入的氨气与HCO3﹣反应:NH3+HCO3﹣→CO32﹣+NH4+
C.加食盐是为增大溶液中Cl﹣的浓度
D.由题可知温度较低时,氯化铵的溶解度比氯化钠的大
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
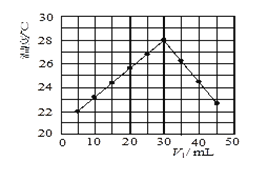
(1)研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22 ℃,判断的依据是____________
(2)由题干及图形可知,V1/V2=__________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为___________mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式:____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com