
科目: 来源: 题型:
【题目】某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
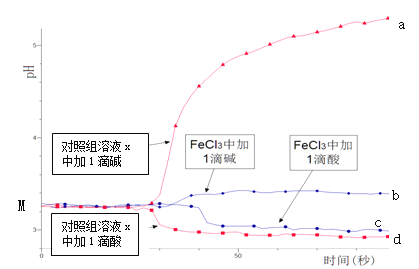
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
查看答案和解析>>
科目: 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2-3g)、适量水和少量乙醇,再加两倍于乙醇体积的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热(如图所示)。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下,请回答下列问题:
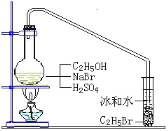
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)写出该方法制备溴乙烷(C2H5Br)的化学方程式_____
(2)图中的试管放入冰水混合物的目的是_____。
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是_____。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】我们已经学习了几种典型的有机化学反应类型,写出下列反应的化学反应方程式,并判断其反应类型。
(1)由乙醇制乙烯_____属于_____反应。
(2)由苯制取硝基苯_____属于_____反应。
(3)由乙醇制乙醛_____属于_____反应。
(4)由丙烯腈(CH2=CH-CN)制备聚丙烯腈(人造羊毛的主要成分):_____,属于_____反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知短周期元素M、N、P、Q最高价氧化物对应水化物分别为X、Y、Z、W,M是短周期中原子半径最大的元素,常温下X、Z、W均可与Y反应,M、P、Q的原子序数及0.1mol/LX、Z、W溶液的pH如图所示。下列说法正确的是( )
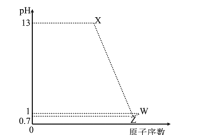
A.N原子的电子层数与最外层电子数相等
B.M的离子半径小于N的离子半径
C.P氢化物稳定性大于Q氢化物稳定性
D.X、W两物质含有的化学键类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
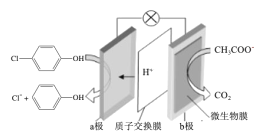
A.b为电池的正极,发生还原反应
B.电流从b极经导线、小灯泡流向a极
C.当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA
D.a极的电极反应式为:![]() +2e-+H+=Cl-+
+2e-+H+=Cl-+![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃通过催化加氢后得到2-甲基丁烷,该烃不可能是( )
A. 3-甲基-1-丁炔B. 2-甲基-1-丁炔
C. 3-甲基-1-丁烯D. 2-甲基-1-丁烯
查看答案和解析>>
科目: 来源: 题型:
【题目】化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法错误的是( )
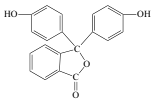
A.酚酞的分子式为C20H14O4
B.酚酞具有弱酸性,且属于芳香族化合物
C.1mol酚酞最多与2molNaOH发生反应
D.酚酞在碱性条件下能够发生水解反应,呈现红色
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
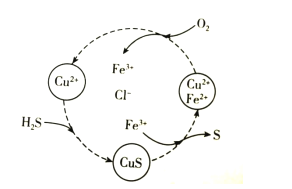
A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O2![]() 2S+2H2O
2S+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的物质的量为0.5mol
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是
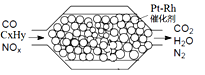
A. 尾气造成“雾霾”与汽油未充分燃烧有关
B. 尾气处理过程,氮氧化物(NOX)被还原
C. Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D. 使用氢氧燃料电池作汽车动力能有效控制雾霾
查看答案和解析>>
科目: 来源: 题型:
【题目】钠离子电池由于成本低、资源丰富,成为取代锂离子电池在大规模储能领域应用的理想选择。作为钠离子电池的正极材料之一,束状碳包覆K3V2(PO4)3纳米线电极材料成为关注焦点之一。其制备工艺流程如图:
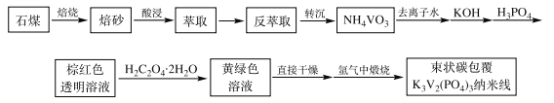
(资料)
①石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质。
②+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
![]()
(1)K3V2(PO4)3中V的化合价为___。
(2)焙烧时,向石煤中加生石灰,将V2O3转化为Ca(VO3)2。
①为了提高焙烧过程中氧化效率,下述工艺步骤方法合理的是___。
a.在回转窑进行富氧焙烧,助燃风气量为煤气量的0.5~2倍
b.焙烧过程中,在焙烧物料中加入辅助剂,增加物料疏松度和透气性
c.窑体进行分段控温
d.调控料层厚度为窑体的2/3高度
②焙烧过程中主要反应的化学方程式为__________。
(3)实验时将NH4VO3、KOH和H3PO4按物质的量分别为5mmol、7.5mmol、7.5mmol依次溶解于20mL去离子水中,溶液颜色依次为白色浑浊、无色澄清透明和棕红色透明溶液。随后再加入H2C2O4·2H2O,搅拌至溶液变为黄绿色,草酸的量对K3V2(PO4)3形貌的影响如下:

①实验条件下束状碳包覆K3V2(PO4)3纳米线样品制备的最佳条件为___。
②亚硫酸钠是常用的还原剂,但实验中不能用亚硫酸钠代替草酸晶体,原因是___。
(4)加入的草酸晶体是过量的,其中只有![]() 的草酸为还原剂,将VO3-还原成VO2+,
的草酸为还原剂,将VO3-还原成VO2+,![]() 的草酸以C2O42-的形式存在,此过程中反应的离子方程式为___。
的草酸以C2O42-的形式存在,此过程中反应的离子方程式为___。
(5)“氩气中煅烧”时,氩气的作用是___。
(6)某工厂利用上述工艺流程,用10t石煤生产束状碳包覆K3V2(PO4)3纳米线0.8064t,若整个过程中钒的总回收率为80%,则石煤中钒元素的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com