
科目: 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,在同周期元素的原子中,W的半径最大;Z的原子序数等于X、Y原子序数之和,A、B、C分别为X、Y、Z形成的二元化合物,D、M分别为Y、Z元素形成的单质,相互转化关系如图。下列说法正确的是( )

A.W、Z、Y、X元素的原子半径依次减小
B.简单气态氢化物的沸点Z比W的高
C.工业上可用电解熔融的W元素氯化物制备W
D.非金属性:Y>Z>X
查看答案和解析>>
科目: 来源: 题型:
【题目】合成有机玻璃单体的一种方法如下,下列有关说法正确的是( )
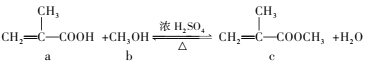
A.a、b、c均易溶于水和有机溶剂
B.与a具有相同官能团的同分异构体还有1种
C.a、c分子中碳原子一定在同一平面上
D.a、c均能发生加成、氧化、取代和还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其电极a常用掺有石墨烯的S8材料,电极反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是
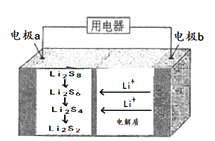
A. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
B. 电解池中加入少量硫酸增强导电性
C. 电池充电时间越长,电池中的Li2S2量越多
D. 电池工作时,负极可发生反应: 2Li2S6+2Li++2e-=3Li2S4
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.已知t℃时,MgCO3的Ksp=4×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA
B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA
C.CO2通过Na2O2使其增重bg时,反应中转移的电子数为![]()
D.1mol带有乙基支链的烷烃,分子中所含碳原子数最少为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于难溶电解质溶解平衡的说法正确的是
A. 可直接根据 Ksp 的数值大小比较难溶电解质在水中的溶解度大小
B. 在 AgCl 的饱和溶液中,加入蒸馏水, Ksp(AgCl)不变
C. 难溶电解质的溶解平衡过程是可逆的,且在平衡状态时 v溶解=v沉淀=0
D. 25℃时, Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量 KI 固体,一定有黄色沉
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
A. 升高温度,K增大B. 减小压强,n(CO2)增大
C. 充入一定量的氮气,n(H2)不变D. 更换高效催化剂,CO的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂被誉为“高能金属”,是锂电池的电极材料,工业上用β-锂辉矿(主要成分为Li2O·Al2O3·4SiO2以及少量钙、镁杂质)和氟磷灰石(Ca5P3FO12)联合制取锂离子电池正极材料(LiFePO4),其工业生产流程如图:

已知:①Ksp[Al(OH)3]=2.7×10-34;
②LiFePO4难溶于水。
回答下列问题:
(1)氟磷灰石(Ca5P3FO12)中磷元素的化合价为___,沉淀X的主要成分是___(写化学式)。
(2)操作3的名称是___,操作1所需的玻璃仪器名称为___。
(3)蒸发浓缩Li2SO4溶液的目的是___。
(4)写出合成反应的离子方程式___。
(5)科学家设计一种锂电池的反应原理为LiFePO4![]() Li+FePO4,放电时正极反应式为___。
Li+FePO4,放电时正极反应式为___。
(6)工业上取300吨含氧化锂5%的β-锂辉矿石,经上述变化得到纯净的LiFePO4共110.6吨,则元素锂的利用率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
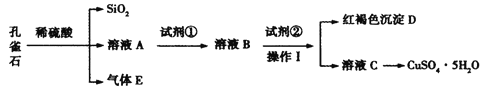
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
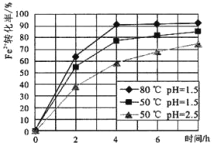
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施:
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
能提高NO2转化率的是_______(填字母)。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K=______。
N2O4(g)的平衡常数K=______。
(4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2
混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com