
科目: 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___________,步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________。
(2)步骤④的离子方程式是_______________。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s) + 3H2(g)![]() W (s) + 3H2O (g),请回答下列问题:
W (s) + 3H2O (g),请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率______;该反应的平衡常数表达式K=_____。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为______(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2(g)![]() WI4(g)。下列说法正确的有__________。
WI4(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看答案和解析>>
科目: 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有溶质NaCl和![]() ,物质的量之比为3:1。用石墨作电极电解该溶液,根据电极产物的不同,可明显分为三个阶段,下列叙述不正确的是( )
,物质的量之比为3:1。用石墨作电极电解该溶液,根据电极产物的不同,可明显分为三个阶段,下列叙述不正确的是( )
A.阴极只析出H2B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水D.溶液pH不断增大,最后为7
查看答案和解析>>
科目: 来源: 题型:
【题目】某体系中存在如下反应:①H2S+4H2O-8e = SO42-+10H+,②2IO3-+12 H++10e = I2+6H2O。
(1)反应①中H2S做_____剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成______g I2。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:_____。
(4)由上述反应可推知__________。
a.氧化性:K2SO4> KIO3 b.酸性:HIO3> H2SO4
c.还原性:H2S > I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】含有一定量NaOH溶液中,逐渐通入一定量 CO2,充分反应后,将溶液在一定条件下进行蒸干,得到晶体物质。其质量m 与通入气体体积V(CO2)的关系如图。如下说法正确的是
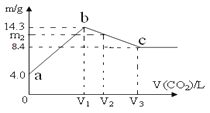
A.晶体物质:a点是NaOH;b点是Na2CO3;c点是NaHCO3
B.a→b 和 b→c 两段过程得到的晶体,含有相同的晶体物质
C.整个过程中的溶液,一定存在恒等式:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-)
D.若通入V2=1.344 L (标况) 气体,则m2=13.12 g
查看答案和解析>>
科目: 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:NH4+、Cl-、Mg2+、Ba2+、K+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是
A.K+可能存在B.该溶液中含CO32-离子的浓度为0.2mol/L
C.Cl-一定不存在D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目: 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
科目: 来源: 题型:
【题目】让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1 +ΔH2-3ΔH3)
(ΔH1 +ΔH2-3ΔH3)
B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1-ΔH2+3ΔH3)
(ΔH1-ΔH2+3ΔH3)
D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com