
科目: 来源: 题型:
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能,乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。关于甲、乙的说法正确的是
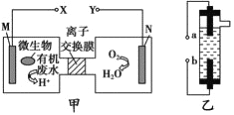
A. 装置乙中的b极要与装置甲的X极连接
B. 装置乙中a极的电极反应式为:2Cl- -2e-=Cl2↑
C. 当N极消耗5.6L(标准状况下)气体时,则有2NA个H+通过离子交换膜
D. 若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极反应为: C6H12O6+6H2O-24e-=6CO2↑+24H+
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置 | 编号 | 试剂X | 实验现象 |
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)怎样配制FeCl3溶液? ________________________________________________________。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________。
(3)实验I中负极的电极反应式为______________________________________________________。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置 | 编号 | 反应时间 | 实验现象 |
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3-![]() Fe(OH)3 +3SO2;②_____________________________________________。
Fe(OH)3 +3SO2;②_____________________________________________。
![]()
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________。
(实验反思)
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________有关(写出两条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
A. 2 mol NH3和5 mol O2充分反应,达到平衡时放出热量为453 kJ
B. 平衡时5v正(O2)=4v逆(NO)
C. 平衡后降低温度,混合气体中NH3含量减小
D. 平衡后减小压强,混合气体平均摩尔质量增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是( )
A. 开启啤酒有泡沫逸出
B. 双氧水中加入二氧化锰气泡产生速率加快
C. 合成氨增压,氨产率增大
D. 装有NO2的烧瓶置于热水中颜色加深
查看答案和解析>>
科目: 来源: 题型:
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示
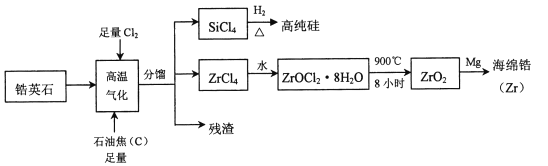
(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组拟从I2-CCl4中提取碘并回收CCl4,查阅资料得到如下信息:
I2 | 紫黑色晶体,沸点184.3°C,易升华,升华后易凝华。在水中的溶解度很小,易溶于许多有机溶剂中 |
CCl4 | 无色有毒液体,沸点76.8℃,易挥发,与水互不相溶,可与乙醇、乙醚、氯仿及石油醚等混溶,不可燃烧,常作有机溶剂。 |
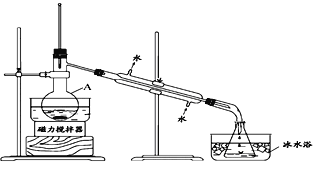
I.兴趣小组根据表中信息并结合已学知识,按上图组装仪器进行实验:
(1)该装置中仪器A的名称是____________。
(2)锥形瓶置于冰水中的目的是_____________。
(3)实验结果发现得到的CCl4呈浅紫红色。为进一步提纯CCl4,拟采用除杂分液的方法进行提纯,则下列操作次序正确的是:_______________________________。
①静置,待液体分层后,分液 ②加入稍过量的Na2SO3溶液 ③充分振荡,放气 ④将待分离溶液转移到分液漏斗中 ⑤对分液漏斗进行检漏
II.由于方法I没有达到预期目标,兴趣小组又设定如下方案进行实验:
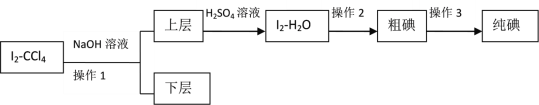
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)操作2的名称是____________。
(5)滴加少量硫酸时,溶液颜色变黄,试写出相应的离子方程式:________________。
(6)该实验中必须要控制NaOH溶液的浓度较_______(填“高”或“低”)和体积较_______(填“大”或“小”),理由是:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液是中学化学中的非常重要的知识点,请根据要求填空。
(1)向NaHSO3溶液滴加石蕊溶液后变红,则HSO3-的电离程度___其水解程度(填“>”或“=”或“<”)。该物质能___(填“促进”或“抑制”)水的电离。
(2)酸碱中和滴定时,不宜用___(填“酚酞”“石蕊”或“甲基橙” )用作指示剂。用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是___(填字母)。
A.未用标准液润洗碱式滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
(3)醋酸(CH3COOH)是一种弱电解质,25℃时,醋酸的电离平衡常数表达式Ka=___。
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___。若物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),则混合后溶液呈___。
(4)现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
①若它们物质的量浓度相等,它们的pH由大到小的关系为___(用abc表示,下同)。
②若它们的pH相等,它们物质的量浓度由大到小的关系为___。
③若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】药物瑞德西韦对新型冠状病毒(COVID-19)有明显抑制作用。K是合成瑞德西韦的关键中间体,其合成路线如下:
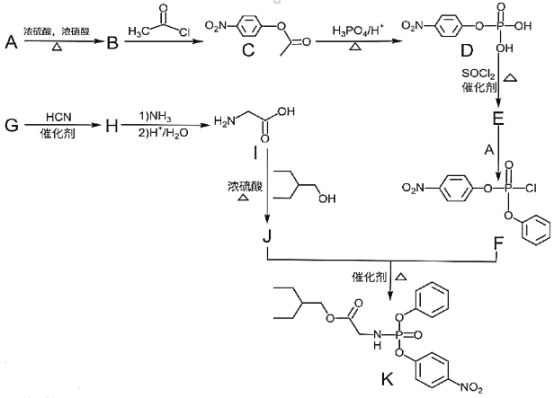
①R-OH![]() R-Cl;
R-Cl;
②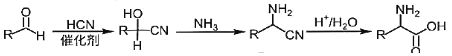
回答下列问题:
(1)B的结构简式为_________________________,B→C的反应类型为_____________,J中含氧官能团的名称为_______________,G→H的反应化学方程式为_____________________________________________。
(2)写出符合下列条件的C的同分异构体X__________________________(填结构简式,不考虑立体异构)。
①苯环上含有硝基且苯环上只有一种氢原子; ②与FeCl3溶液发生显色反应; ③1molX与足量金属Na反应可生成2g H2 。
(3)E中含两个Cl原子,则E的结构简式为________________________________________________。
(4)写出以苯甲醇为原料制备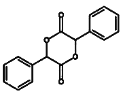 的合成路线(其它试剂任选):________________。
的合成路线(其它试剂任选):________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为________________________。
(2)基态Na原子中,核外电子占据的原子轨道总数为______,Te属于元素周期表中______区元素,其基态原子的价电子排布式为______________________。
(3)CO32-的空间构型为___________________,碳酸丙烯酯的结构简式如图所示,
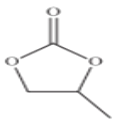
其中碳原子的杂化轨道类型为____________,1mol碳酸丙烯酯中σ键的数目为_________________。
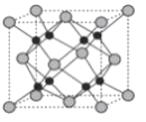
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为____________,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为____________cm(用含有ρ、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com